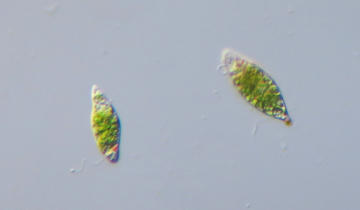
Protocole de culture de deux souches de levures Saccharomyces cerevisiae, ayant des métabolismes différents et donc des exigences différentes.
Introduction
Buts poursuivis
But cognitif : exigences nutritives des levures ; dégager la notion d’hétérotrophie. Le cycle de développement est caractéristique d’une souche de levures dans des conditions de milieu données.
But méthodologique : travailler dans des conditions strictes d’asepsie.
Résultats attendus
- Pas de contamination.
- La souche E ne pousse pas sur glycérol.
- Pour une même souche, souche D, la croissance est différente selon le milieu utilisé.
- La multiplication des levures dépend de la température.
Obtention des souches et des milieux
Sordalab (Z.A. des Poupettes, 91580 Villeneuves sur Auvers).
« Kit levure 1 : croissance et métabolisme » (peut être vendu par éléments) ; Kit entier inutile
Souches et milieux « version poudre ».
Matériel
- Levures : Saccharomyces cerevisiae – souche D (sauvage) ; souche E (ne pousse pas sur glycérol, propriété que les élèves découvriront).
- Les milieux. La nature des milieux est pressentie par les élèves après discussion et réflexion. Les milieux « version poudre » ont été achetés en kit, puis préparés et autoclavés pour l’obtention de divers milieux :
- Milieux liquides par binôme (préparés et stérilisés antérieurement, dans tubes avec bouchons)
- à base de saccharose – M.L.1
- à base d’amidon – M.L.2
- à base de lactose – M.L.3
- à base de glycérol – M.L.4
- à base de glucose – M.L.5
- Milieux solides par binôme (boîtes de Pétri préparées et stérilisées antérieurement)
- à base de glucose dit YPG – M.S.1
- à base de glycérol dit YPGly – M.S.2
- Milieux liquides par binôme (préparés et stérilisés antérieurement, dans tubes avec bouchons)
- pipettes stériles
- champs stériles
- anses pour étaler
Protocole (chronologie)
- Les élèves entrent par la porte du fond de la salle, déposent leurs vêtements au fond de la salle, se lavent les mains au savon, se placent devant les paillasses qui ont été javellisées et à côté des becs Bunsen éclairés depuis 40 minutes. Aucun courant d’air ; fenêtre fermées.
- Ensemencements sur milieux liquides (près du bec Bunsen).
- Chaque binôme dispose d’un tube stérile contenant une suspension à peine trouble de la souche D. Avec pipette stérile, prélèvement de O, I ml dans ce tube au préalable très agité, et ensemencement des 5 milieux liquides M.L.1 ; M.L.2 ; M.L 3 ; M.L.4 ; M.L.5.
- Si les bouchons sont posés, c’est sur le champ stérile et à l’envers.
- Tubes étiquetés (nom des binômes).
- Comptage des levures des 5 milieux ensemencés, sur cellules de Malassez, après agitation de chaque tube, et prélèvement stérile.
- D’abord, faire repérer la partie graduée à l’œil nu.
- Ensuite, placer la cellule de Malassez sur la platine microscope, partie graduée au centre du champ, au faible grossissement, valets fixés sur la lame.
- Repérer la partie graduée au fort grossissement.
- Enfin, déposer sur la cellule de Malassez en place sur la platine, avec une pipette stérile, une goutte de suspension de levures initialement agitée.
- Recouvrir d’une lamelle.
- Compter le nombre de cellules sur 20 petits carreaux (surface adoptée comme référence).
- Les binômes se partagent le comptage des 5 milieux et notent précisément le tube étudié.
- Mesure de la densité optique des 5 milieux ensemencés, avec un spectrophotomètre.
- Cuve très propre (en principe à usage unique), aucune trace de doigts.
- S’assurer que les différentes cuves ne présentent pas de défaut de fabrication, en testant avec de l’eau distillée.
- Dans le cas contraire, utiliser la même cuve pour chacun des milieux (après lavage à l’eau distillée et séchage minutieux).
- Pour chaque milieu vierge, étalonner l’appareil pour trouver la longueur d’onde à utiliser.
- Agiter chaque milieu ensemencé avant chaque mesure.
- Remplir la cuve à moitié pour éviter les débordements.
- Faire 3 mesures pour un même milieu ; les noter.
- Jeter le contenu des cuves dans un récipient qui passera à l’autoclave.
- Les tubes sont répartis en 2 ensembles :
- Un premier ensemble placé à 30 °C dont une moitié mise au réfrigérateur au bout de 2 heures et une moitié mise au réfrigérateur au bout de 3,5 heures.
- Un deuxième ensemble placé à 10 °C dont une moitié mise au réfrigérateur au bout de 2 heures et une moitié mise au réfrigérateur au bout de 3,5 heures.
- Ensemencement sur milieu solide. La moitié des binômes travaille sur Saccharomyces cerevisiae, souche D. L’autre moitié travaille sur Saccharomyces cerevisiae, souche E. Chaque binôme dispose :
- D’un tube contenant un milieu sans sucre, avec suspension à peine trouble soit de la souche D, soit de la souche E.
- De deux boîtes de Pétri contenant un milieu stérile l’une à base de glucose, l’autre à base de glycérol.
- D’une anse à étaler stérile.
- Prélèvement avec l’anse d’une goutte de suspension, après agitation.
- Étalement par stries à la surface d’une boîte de Pétri.
- Chaque élève ensemence une boîte de Pétri, avec l’anse passée à la flamme et refroidie.
Résultats des cultures conservées une semaine au réfrigérateur
- Mesure de la croissance cellulaire sur milieux liquides :
- Sur cellule de Malassez (cf. méthode 4.3.).
- Mesure avec spectrophotomètre. (cf. méthode 4.4).
- Comptage des clones sur milieux solides.
- De plus les élèves réalisent un repiquage sur un même milieu.
- De plus les élèves réalisent un repiquage sur un même milieu.
Résultats obtenus sur milieux liquides à 30 °C ; Souche D
|
Saccharose |
Lactose |
Glycérol |
Glucose |
|
Temps zéro : 0,04 |
Temps zéro : 0,06 |
Temps zéro : 0,00 |
Temps zéro : 0,06 |
|
Temps 3h30 : 0,34 |
Temps 3h30 : 0,38 |
Temps 3h30 : 0,02 |
Temps 3h30 : 0,36 |
|
Mesures au spectrophotomètre. |
|||
Résultats obtenus sur milieux liquides à 10 °C ; Souche D
|
Saccharose |
Lactose |
Glycérol |
Glucose |
|
Temps zéro : 0,04 |
Temps zéro : 0,02 |
Temps zéro : 0,00 |
Temps zéro : 0,06 |
|
Temps 3h30 : 0,09 |
Temps 3h30 : 0,03 |
Temps 3h30 : 0,00 |
Temps 3h30 : 0,08 |
|
Mesures au spectrophotomètre. |
|||
Pas de variation d’absorbance sur les milieux liquides, placés à 10 °C, au bout de 3 heures.
Conclusion :
- Les résultats obtenus avec le spectrophotomètre sont très fiables.
- Plus difficile de conclure avec les numérations faites sur cellules de Malassez ; nécessité d’un très grand nombre de mesures.
- Parfaite concordance entre croissance sur milieu liquide et croissance sur milieu solide (très minuscules colonies de la souche D, sur glycérol, au bout de 48 h, à 30 °C).
- Aucune mesure n’a pu être effectuée sur le milieu avec amidon, tant au spectrophotomètre qu’avec les cellules de Malassez, car le milieu était très opaque ; il aurait fallu le filtrer.
Remarques
Les élèves ont suivi toutes les consignes données.
- Aucune contamination bien que les milieux soient tous dépourvus d’antibiotiques.
- L’agitation forte à la main de tous les milieux liquides ne suffit pas.
- Nécessité d’un Vortex sinon les cellules sont « en paquet » sur cellule de Malassez.
- Les temps de croissance ont été limités à 2 h et 3,5 h pour éviter une trop forte population ; ce qui exigerait une dilution très précise, suivie d’une autre mesure (ensemble plus ou moins fastidieux).
- Depuis le début des cultures de cellules, les élèves ont utilisé plusieurs fois les cellules de Malassez, travail un peu répétitif.
On peut :
- Se contenter des seules mesures sur spectrophotomètres très rapides (l’intérêt étant la comparaison des mesures) ;
- Au préalable, construire pour la levure choisie, la droite d’étalonnage, valable pour de faibles concentrations (absorbance, nombre de cellules par microlitre).
Réalisation d’une courbe d’étalonnage :
- Pour un milieu donné, glucose par exemple, partir d’une concentration donnée, 1 g de levure souche D, dans 100 mL de milieu.
- Agiter sur Vortex puis faire un très grand nombre de mesures sur cellule de Malassez.
- Réaliser une série de dilutions : 1/2, 1/4, 1/8 et 1/10.
- Pour chaque dilution faire une mesure au spectrophotomètre.
- Construire la courbe, absorbance en ordonnée, nombre de cellules en abscisse.
L’expérimentation terminée, il faut éliminer les boîtes utilisées. Une trentaine de boîtes de Pétri en plastique à usage unique sont placées dans un sac en plastique (spécial autoclave). Ce sac ne doit pas être fermé hermétiquement ; ainsi les levures sont tuées et les boîtes fondent. Le résidu est mis à la poubelle.