Alors que les expériences in vitro laissaient à penser que les lymphocytes T cytotoxiques étaient des cellules capables, seules, de détruire cellules infectées et tumorales, les observations in vivo montrent que les LTc ont en réalité besoin d’être plusieurs pour venir à bout de leurs cibles. Cette élimination passe par l’établissement de synapses immunologiques aboutissant à la mort par apoptose des cellules infectées ou cancéreuses. Cependant certaines cellules tumorales disposent de mécanismes d’auto-défense face aux LTc.
Le système immunitaire est constitué d’une diversité de cellules et de molécules, toutes impliquées dans la protection de l’organisme contre les éléments reconnus comme étrangers tels que les agents infectieux (e.g. bactéries, virus, parasites…) ou les cellules cancéreuses. Suite à la reconnaissance de l’agent étranger, des réponses immunitaires sont rapidement mises en place, en moins de quelques heures : ces premières réponses correspondent à l’immunité innée, et font intervenir des cellules et molécules particulières (e.g. cellules dendritiques, macrophages, neutrophiles, protéines du complément…) ainsi qu’un phénomène d’inflammation. Toutefois, si le corps étranger n’est pas éliminé par les réponses innées, une deuxième vague de réponse intervient alors, quelques jours plus tard : c’est l’immunité adaptative, qui repose sur l’action des lymphocytes B et lymphocytes T (LT). Les LT sont divers, mais un type particulier, les LT CD8 (qui tiennent leur nom de leur corécepteur CD8 exprimé à leur surface), jouent notamment un rôle crucial dans la défense de l’organisme contre les pathogènes intracellulaires. En effet, ces lymphocytes reconnaissent et éliminent spécifiquement les cellules infectées, par exemple par des virus. De plus, les LT CD8 reconnaissent également les cellules tumorales et peuvent directement les tuer.
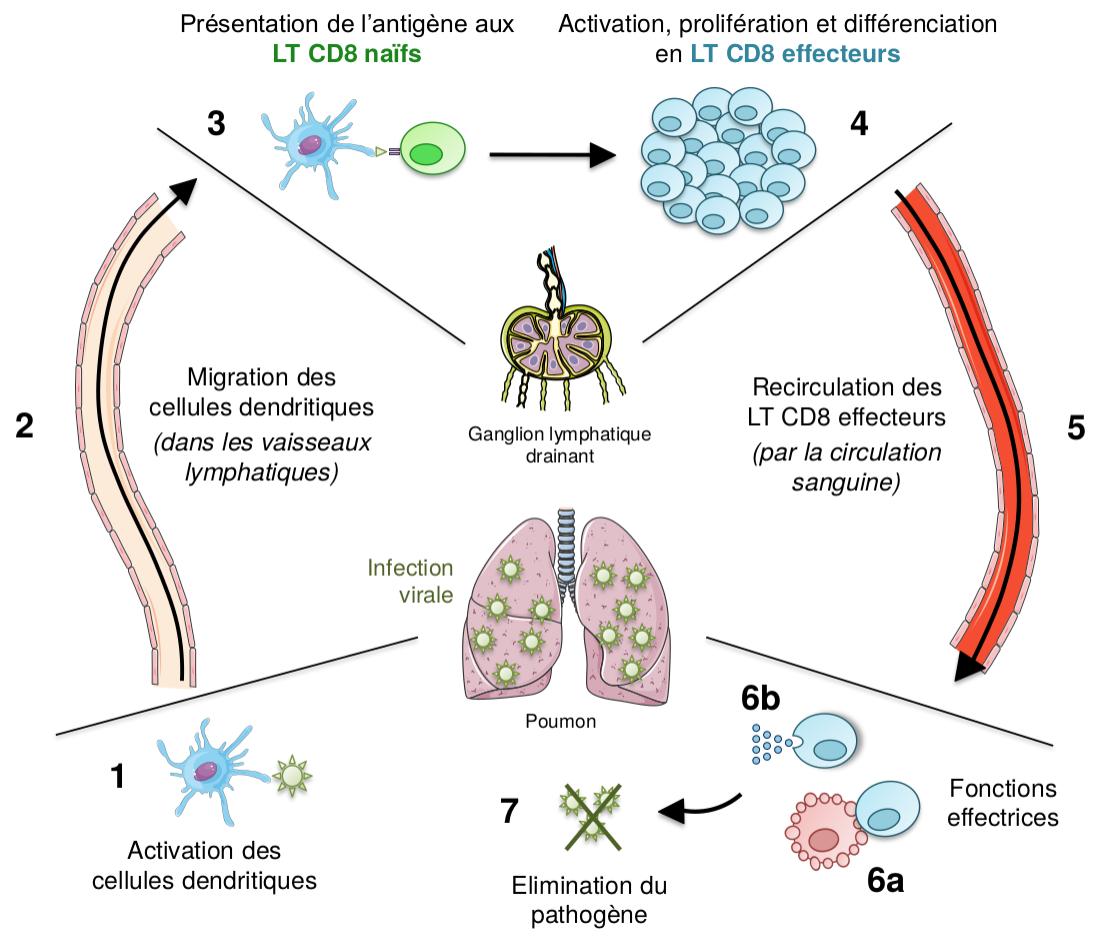
Pour étudier plus précisément les réponses T CD8, prenons le cas d’une infection virale, par exemple dans le poumon (Figure 1). Lors de l’infection du tissu, les cellules dendritiques activées internalisent les antigènes et migrent jusqu’au ganglion drainant le plus proche. À cet endroit, les cellules dendritiques présentent les antigènes aux LT CD8 naïfs, ce qui entraîne l’activation, la prolifération et la différenciation des LT CD8 naïfs ayant spécifiquement reconnu l’antigène. Les LT CD8 effecteurs ainsi formés migrent alors jusqu’au tissu infecté, où ils réalisent leurs fonctions effectrices. (i) Ces cellules sécrètent d’une part des cytokines et chimiokines, ce qui permet le recrutement et l’activation d’autres cellules immunitaires. (ii) De plus, les LT CD8 effecteurs sont capables de reconnaître spécifiquement leurs cellules cibles, ici les cellules infectées, et de les tuer par des processus de cytotoxicité. Cette propriété des LT CD8 effecteurs leur a d’ailleurs valu le nom de LT cytotoxiques (LTc).
Lors de l’infection virale d’un tissu, ici le poumon, les cellules dendritiques activées (1) internalisent les antigènes pathogéniques et migrent par les vaisseaux lymphatiques jusqu’au ganglion lymphatique drainant (2). Une fois dans cet organe, les cellules dendritiques présentent les antigènes aux LT CD8 naïfs (3) qui sont activés, prolifèrent et se différencient en LT CD8 effecteurs (4), qui migrent dans la circulation sanguine jusqu’au tissu infecté (5). Ces LT effecteurs initient alors leurs fonctions effectrices (i.e. lyse des cellules cibles (6a), sécrétion de cytokines (6b)), permettant l’élimination du virus (7).
Le caractère de « tueur » des LTc constituait jusqu’ici la vision paradigmatique. Toutefois, des observations récentes semblent indiquer que ces cellules auraient finalement des propriétés cytotoxiques moins efficaces que ce qui était pensé initialement. En effet, certaines observations ont mis en évidence que les LTc n’éliminaient pas toujours leurs cibles de façon optimale, notamment dans le cas où ces dernières étaient des cellules cancéreuses (Budhu et al., 2010; Khazen et al., 2016). Alors, tueurs ou non nos LTc ?
Dans cet article, nous étudierons tout d’abord les mécanismes mis en place par les LTc pour tuer leurs cellules cibles. Puis, dans les deux parties suivantes nous discuterons de l’efficacité de ce processus, tout d’abord en nous focalisant sur les LT CD8, puis en étudiant leurs cibles et les mécanismes qui permettent à celles-ci d’échapper aux LTc.
Les LTc interagissent avec leurs cellules cibles et les tuent
Établissement d’un contact avec la cellule cible et sécrétion du contenu des granules lytiques
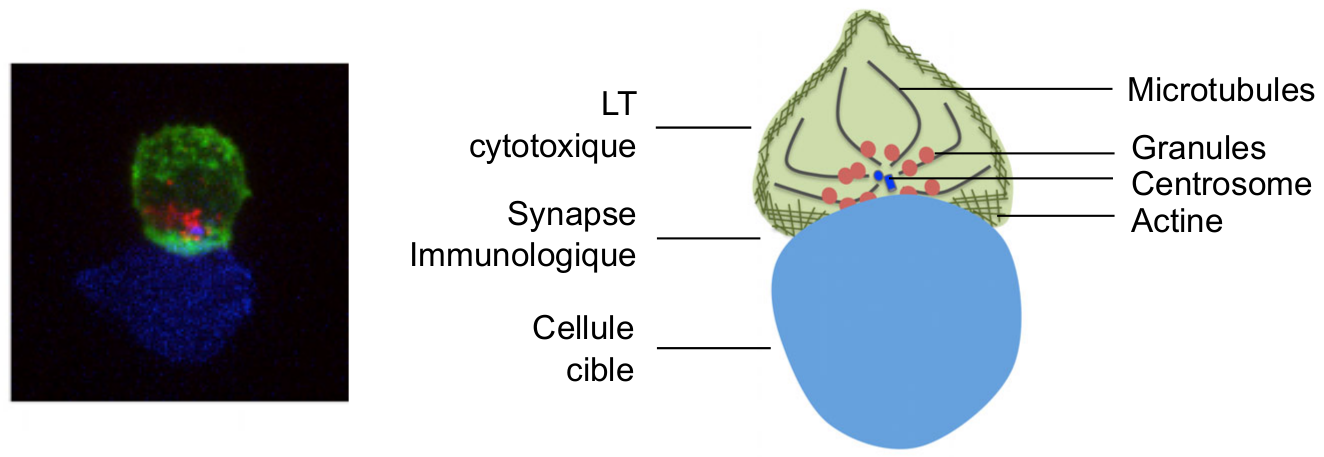
La synapse immunologique cytotoxique correspond à la zone de jonction stable entre un LTc (en vert) et sa cellule cible (en bleu). L’actine, en périphérie de la synapse, favorise la stabilisation de la synapse et la signalisation en aval des récepteurs T. Les granules lytiques, dont le déplacement s’effectue en association avec le centrosome le long des microtubules, migrent vers le centre de la synapse pour y être sécrétés.
Lors de leur migration au sein du tissu infecté, les LTc établissent des contacts avec leurs cellules cibles. Au niveau moléculaire, ces contacts reposent sur l’interaction des récepteurs T, les TCR, avec les antigènes présentés à la surface des cibles. La reconnaissance spécifique de l'antigène aboutit à la formation d'une synapse immunologique (i.e. zone de jonction stable entre deux cellules, dont au moins une cellule immunitaire, ici entre un LTc et sa cible) (Figure 2) . Nous pouvons noter que l’établissement de la synapse cytotoxique se fait de façon très rapide, en moins de trois minutes après l'initiation du contact (Wiedemann et al., 2006 ; de la Roche et al., 2016).
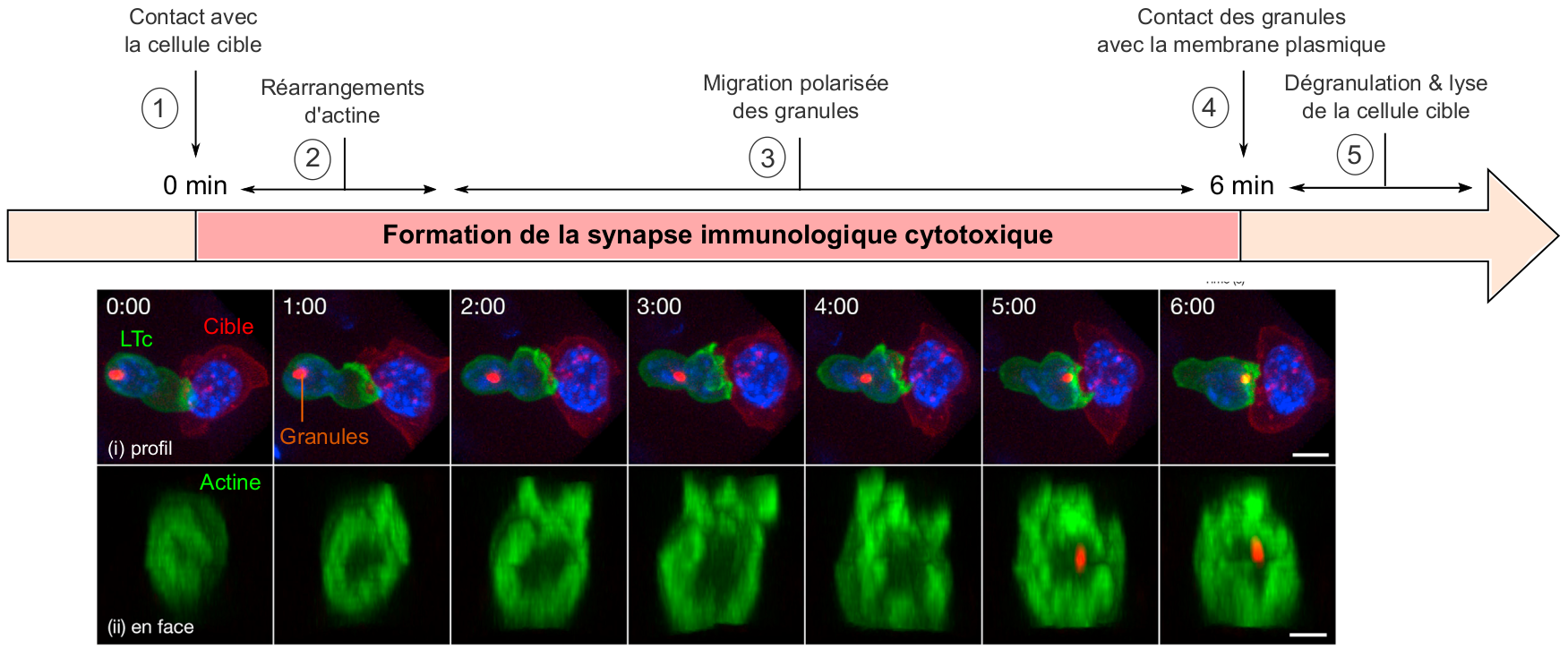
Des expériences de vidéo-microscopie à haute résolution ont permis de visualiser la dynamique temporelle de formation de la synapse immunologique cytotoxique (Figure 3) (Ritter et al., 2015). Celle-ci débute par des réarrangements du cytosquelette d’actine à l'interface entre le LTc et sa cible, en moins d'une minute après l'initiation du contact, ce qui favorise l’interaction et la communication entre les deux cellules. Dans la minute suivante, les récepteurs TCR se regroupent au centre de la synapse, renforçant ainsi la signalisation en aval de ces récepteurs et la mise en place des fonctions effectrices du LTc. Enfin, les granules cytotoxiques entament leur migration polarisée vers la zone de contact LTc-cible, et arrivent au niveau de la synapse environ 6 minutes après la mise en place de l'interaction LTc-cible. La libération de leur contenu par exocytose induit alors la mort de la cellule cible, selon des processus que nous allons maintenant détailler.
Suite à la reconnaissance de la cellule cible (1), l’actine (en vert), initialement concentrée au centre de la synapse, se réorganise et se relocalise sous forme d’un anneau en périphérie (2). Ensuite, les granules (associés au centre organisateur des microtubules, en orange) migrent en direction de la synapse (3) et contactent la membrane plasmique (4). Le contenu des granules lytiques est alors sécrété à cet endroit, ce qui induit la lyse de la cellule cible (5) .
Mort de la cellule cible : exemple du rôle des granzymes et de la perforine
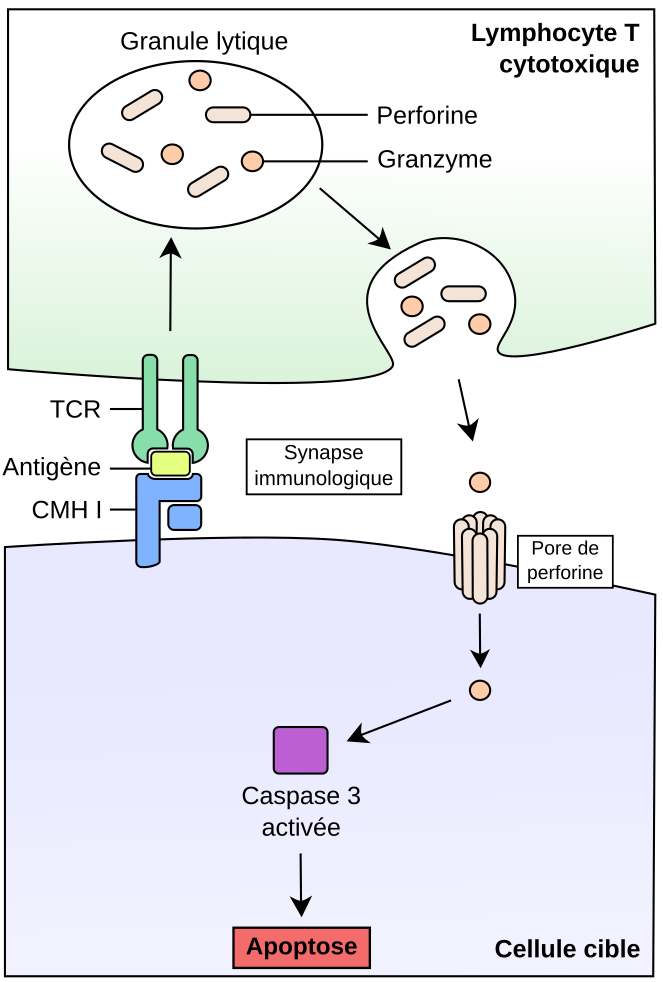
La lyse de la cellule cible suite à l’exocytose des granules repose en particulier sur l'action de plusieurs molécules contenues dans les granules du LTc : les granzymes et la perforine. La perforine, comme son nom l’indique, forme des pores de taille nanométrique dans la membrane de la cellule cible (Baran et al., 2009; Voskoboinik et al., 2015). Les protéines de la famille des granzymes sont quant à elles des enzymes capables d’induire la mort cellulaire, en clivant des molécules régulatrices de l’apoptose (i.e. processus de mort cellulaire programmée) (Voskoboinik et al., 2015).
Suite à la reconnaissance de l’antigène par le TCR et la formation de la synapse immunologique cytotoxique, les granules lytiques sont sécrétés par le LTc au niveau de la synapse. La libération des molécules de perforine induit la formation de pores dans la membrane plasmique de la cellule cible, favorisant l’entrée des molécules de granzyme. Ces enzymes clivent alors de nombreux substrats, dont des molécules effectrices de l’apoptose comme les caspases, ce qui aboutit à la mort de la cellule cible.
La dynamique d’action du système granzyme-perforine a été quantifiée pour la première fois en 2013, grâce à des études biochimiques couplées à de la microscopie en temps réel (Lopez et al., 2013). Ces expériences ont montré que suite à la sécrétion des molécules de perforine, des pores étaient formés dans la membrane plasmique de la cellule cible en moins de 30 secondes, permettant l’entrée des granzymes (Figure 4). La mort cellulaire est ensuite déclenchée dans les deux minutes suivant la formation des pores, suite au clivage par les granzymes de diverses molécules effectrices et/ou régulatrices de l’apoptose (e.g. caspases), ce qui induit l’activation des voies apoptotiques. On peut de plus noter que la formation des pores est très transitoire (ceux-ci se referment moins d’1 min 30 après leur formation), ce qui empêche les molécules de granzyme de diffuser vers d’autres cellules. Le processus de cytotoxicité est donc très rapide (50 % des cellules cibles rentrant en apoptose en moins de 10 minutes) et très spécifique de la cible, la structure de la synapse empêchant également la diffusion des enzymes lytiques vers les cellules adjacentes (i.e. présence de molécules d’adhérence en périphérie de la synapse, rapprochant les membranes des deux cellules et limitant ainsi la fuite de molécules). Par ailleurs, l’existence de mécanismes inhibiteurs dans le LTc (e.g. présence d’inhibiteurs de granzyme B) limite l’action des granzymes et de la perforine sur les LTc eux-mêmes.
Les LTc : de vrais tueurs en série ?
Ainsi, les LTc tuent leurs cellules cibles rapidement (en quelques minutes seulement dans des expériences de culture in vitro) et efficacement, et sont considérés depuis longtemps comme capables de tuer successivement de nombreuses cibles in vitro (Rothstein et al., 1978; Wiedemann et al., 2006). Ces observations valurent d’ailleurs aux LTc leur surnom de « serial killer », et permirent d’extrapoler qu’un seul LTc serait capable de tuer plusieurs centaines de cellules cibles par jour.
Ces hypothèses initiales étant émises à partir de résultats obtenus in vitro, peu de choses étaient alors connues sur les propriétés cytotoxiques réelles des LTc au sein de l’organisme. Jusqu’à ce qu’en 2016, une étude majeure soit publiée et révèle le comportement des LTc in vivo en cas d’infection virale (Halle et al., 2016). L’utilisation de la microscopie bi-photonique a permis aux auteurs de l’étude d’évaluer que la lyse des cellules cibles ne pouvait être réalisée par un seul LTc mais nécessitait en général l’intervention de plusieurs de ces cellules (3,5 LTc sont requis en moyenne pour tuer une cible) (Figure 5). Par ailleurs, un unique LTc contribuerait à la mort de 2 à 16 cellules infectées par jour. Ainsi, contrairement à ce qui avait été démontré in vitro, les LTc agiraient plutôt en bandes pour tuer efficacement et rapidement un grand nombre de cibles. Cette nécessité d’une coopérativité des LTc pour tuer leurs cibles pourrait notamment être liée à l’hétérogénéité fonctionnelle de ces lymphocytes, concernant par exemple leur capacité à induire la signalisation intracellulaire en aval du récepteur TCR ou leur niveau d’expression des molécules de granzymes et de perforine (Newell et al., 2012; Vasconcelos et al., 2015; Halle et al., 2016). De plus, contrairement aux expériences in vitro utilisant généralement des cultures « simples » avec des lignées cellulaires souvent faciles à tuer, de nombreux autres paramètres interviennent in vivo (e.g. inflammation, présence d’autres types cellulaires comme des LT régulateurs, mécanismes inhibiteurs induits par les cellules cibles…) et pourraient expliquer les différences observées dans les capacités cytotoxiques des LTc in vitro et in vivo. Ainsi in vivo, les LTc aux propriétés effectrices plus faibles ne pourraient pas tuer tout seuls leurs cellules cibles, dont la lyse nécessiterait alors l’intervention d’autres LTc plus compétents.
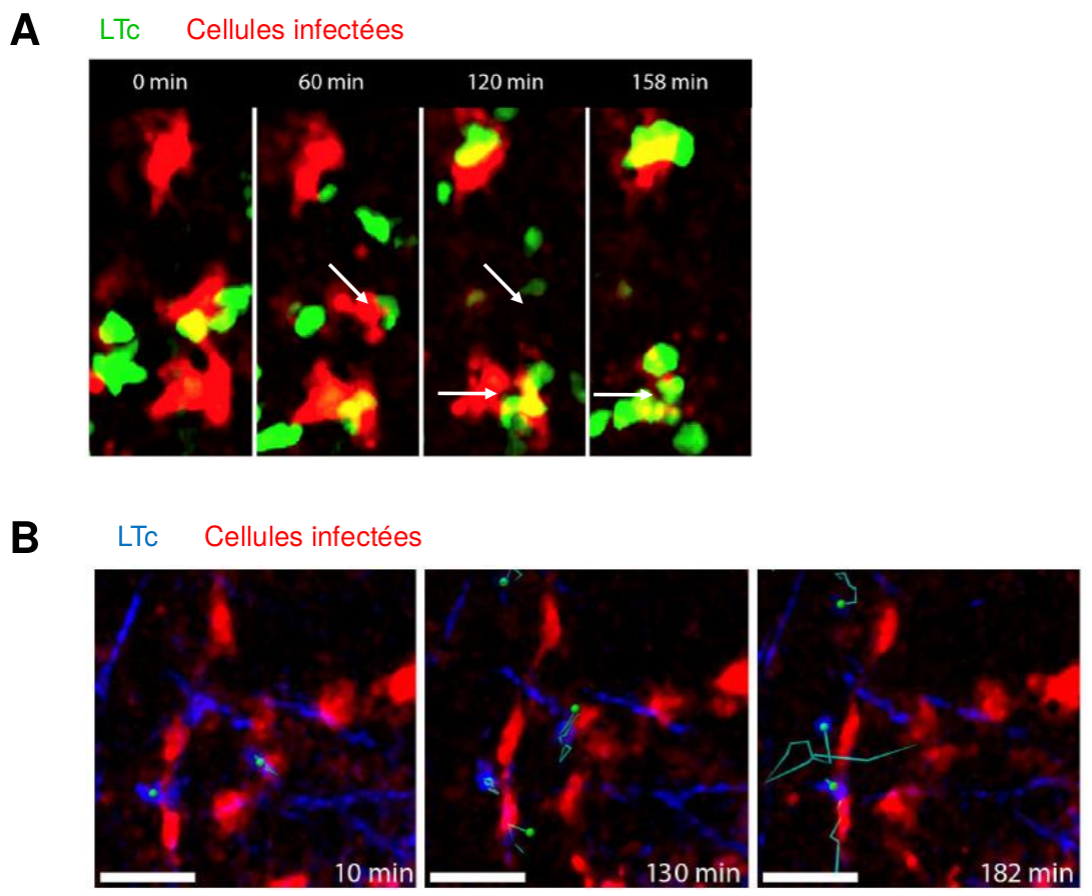
Observation par microscopie bi-photonique de LTc et de cellules infectées dans le ganglion lymphatique, après infection de souris par le virus MCMV.
(A) Plusieurs LTc (en vert) sont observés au niveau des cellules infectées (en rouge) : leur action cumulée aboutit à la mort de la cellule cible (flèches blanches).
(B) En revanche, lorsque peu de LTc (en bleu, déplacement suivi par des tracés) sont présents dans le ganglion lymphatique, leur action ne suffit pas à tuer les cellules cibles (en rouge) qui restent alors intactes.
Les durées indiquées correspondent au temps suivant le début de l’enregistrement.
Pour résumer, les LTc agiraient donc en bandes organisées, dont le regroupement et la coopération leur permettrait d’éliminer efficacement leurs cellules cibles. Toutefois, beaucoup de questions restent en suspens, notamment en ce qui concerne les paramètres liés à l’efficacité de la cytotoxicité in vivo, qui varient beaucoup selon les modèles utilisés (e.g. infection virale vs tumeur). Des études complémentaires sont donc encore nécessaires pour mieux comprendre les interactions entre les LTc et leurs cibles, et pouvoir optimiser l’utilisation des LTc en tant qu’objet thérapeutique potentiel.
Quand les cellules cibles contre-attaquent…
Influence des cellules cibles sur le potentiel cytotoxique du LTc
En plus de processus intrinsèques aux LT CD8, l’efficacité du phénomène cytotoxique peut varier en fonction des cellules ciblées par les LTc.
D’une part, la nature des cellules cibles peut moduler l’efficacité de leur lyse par les LTc. En effet, certaines cellules, comme les cardiomyocytes, semblent intrinsèquement plus résistantes à l’apoptose (Zheng et al., 2016).
D’autre part, les cellules tumorales ou infectées peuvent mettre en place des mécanismes d’échappement à l’action des LTc, par exemple en diminuant l’expression des molécules permettant la présentation des antigènes à leur surface (i.e. molécules de CMH-I) (Halle et al., 2016).
Mise en place de mécanismes d’auto-défense par les cellules cibles
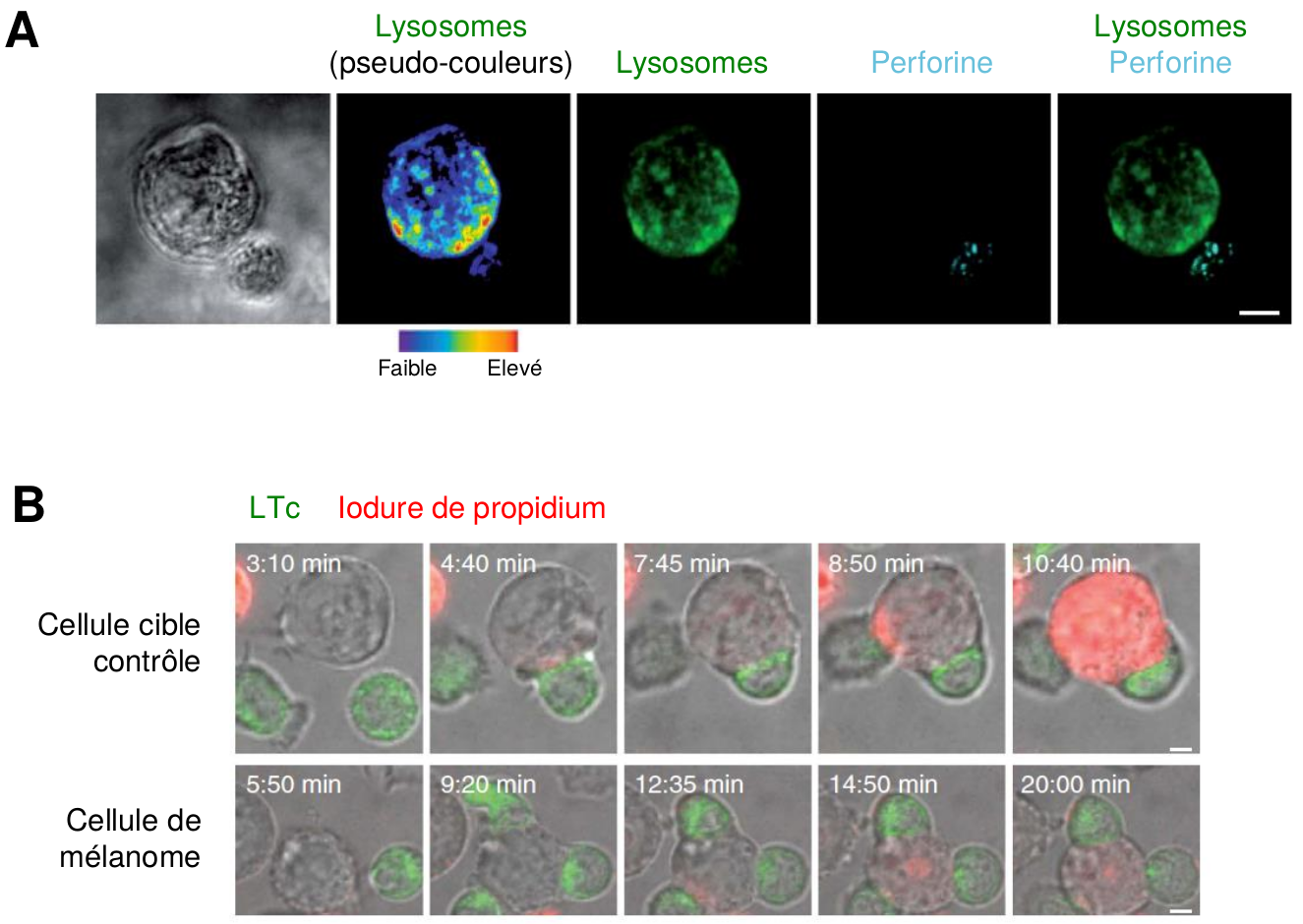
D’autres études récentes ont mis en évidence que certains types de cellules ciblées par les LTc, notamment les cellules de mélanome (i.e. une forme de cancer de la peau), étaient capables de contrer directement l’action cytotoxique des LTc (Khazen et al., 2016). En effet, des observations par microscopie confocale ont montré que suite à l’interaction avec les LTc, le contenu des lysosomes de la cellule de mélanome est exocyté au niveau de la zone de contact (Figure 6A). Les molécules de perforine sont alors dégradées par les enzymes lysosomales, empêchant ainsi la formation des pores dans la membrane de la cellule cancéreuse et l’apoptose de cette dernière (Figure 6B).
A- Les cellules de mélanome sécrètent des lysosomes au niveau de la synapse immunologique.
Observation par microscopie confocale d’une cellule de mélanome (grosse cellule, en haut) en contact avec un LTc (petite cellule, en bas). Les cellules ont été marquées de façon à visualiser leurs lysosomes (en vert ou en pseudo-couleurs) et les molécules de perforine (en bleu).
Barre d’échelle : 5 µm.
B- Les cellules de mélanome résistent au processus cytotoxique.
Observation par microscopie confocale de cellules cibles contrôles (en haut) ou de cellules de mélanome (en bas) interagissant avec des LTc (marqués en vert), à différents temps après le début de la co-culture. La formation des pores par la perforine est détectée grâce à l’entrée d’iodure de propidium (en rouge) dans la cellule cible.
Barre d’échelle : 5 µm.
Ces résultats novateurs ont ainsi mis en évidence une origine potentielle de l’inefficacité des LTc face aux cellules de mélanome, un phénomène observé à la fois en culture in vitro mais également dans le cas des thérapies actuelles utilisées pour traiter les patients atteints de ce type de cancer. La découverte de ces mécanismes d’auto-défense, bien qu’étant encore à étudier sur d’autres types de cellules tumorales, ouvre ainsi la voie à la mise au point de nouvelles thérapies pouvant cibler ces processus, ce qui permettrait d’augmenter l’efficacité de l’action anti-tumorale des LTc et d’optimiser leur utilisation en tant qu’outil thérapeutique anticancéreux.
Conclusion
Grâce à leurs capacités cytotoxiques, les LTc sont capables d’éliminer les cellules infectées et les cellules tumorales, et sont ainsi considérés comme les tueurs du système immunitaire. Au vu de ces propriétés, qui commencent à être de mieux en mieux caractérisées, les LTc sont des cellules clés fréquemment ciblées dans les thérapies anticancéreuses. Classiquement, ces thérapies visent à améliorer l’efficacité des réponses T CD8 face à la tumeur, et ce en utilisant diverses stratégies (e.g. vaccination avec des cellules dendritiques présentatrices des antigènes tumoraux, injection de LT CD8 spécifiques de la tumeur…). Toutefois, ces méthodes ont pour l’instant une efficacité limitée, notamment chez les patients atteints de mélanome, et présentent de forts risques d’effets secondaires pour les patients.
L’identification récente de mécanismes de résistance des cellules tumorales ouvre ainsi un nouvel angle d’approche pour renforcer les thérapies anticancéreuses actuelles, en ciblant non plus les réponses T CD8 mais les cellules tumorales elles-mêmes. De nouvelles thérapies plus efficaces pourraient ainsi voir le jour, en combinant des approches visant à la fois à optimiser les réponses T CD8, tout en limitant la résistance de leurs cellules cibles.
Références
- Baran K, Dunstone M, Chia J, Ciccone A, Browne KA, Clarke CJP, et al. (2009). The molecular basis for perforin oligomerization and transmembrane pore assembly. Immunity 30: 684–95.
- Budhu S, Loike JD, Pandolfi A, Han S, Catalano G, Constantinescu A, et al. (2010). CD8+ T cell concentration determines their efficiency in killing cognate antigen-expressing syngeneic mammalian cells in vitro and in mouse tissues. J Exp Med 207: 223–35.
- Halle S, Keyser KA, Stahl FR, Busche A, Marquardt A, Zheng X, et al. (2016). In Vivo Killing Capacity of Cytotoxic T Cells Is Limited and Involves Dynamic Interactions and T Cell Cooperativity. Immunity 44: 1–13.
- Khazen R, Müller S, Gaudenzio N, Espinosa E, Puissegur M-P, Valitutti S (2016). Melanoma cell lysosome secretory burst neutralizes the CTL-mediated cytotoxicity at the lytic synapse. Nat Commun 7: 10823.
- de la Roche M, Asano Y, Griffiths GM (2016). Origins of the cytolytic synapse. Nat Rev Immunol 16: 421–432.
- Lopez JA, Susanto O, Jenkins MR, Lukoyanova N, Sutton VR, Law RHP, et al. (2013). Perforin forms transient pores on the target cell plasma membrane to facilitate rapid access of granzymes during killer cell attack. Blood 121: 2659–2668.
- Newell EW, Sigal N, Bendall SC, Nolan GP, Davis MM (2012). Cytometry by time-of-flight shows combinatorial cytokine expression and virus-specific cell niches within a continuum of CD8+ T cell phenotypes. Immunity 36: 142–52.
- Ritter AT, Asano Y, Stinchcombe JC, Dieckmann NMG, Chen B-C, Gawden-Bone C, et al. (2015). Actin Depletion Initiates Events Leading to Granule Secretion at the Immunological Synapse. Immunity 42: 864–876.
- Rothstein TL, Mage M, Jones G, McHugh LL (1978). Cytotoxic T lymphocyte sequential killing of immobilized allogeneic tumor target cells measured by time-lapse microcinematography. J Immunol 121: 1652–6.
- Vasconcelos Z, Müller S, Guipouy D, Yu W, Christophe C, Gadat S, et al. (2015). Individual Human Cytotoxic T Lymphocytes Exhibit Intraclonal Heterogeneity during Sustained Killing. Cell Rep 11: 1474–85.
- Voskoboinik I, Whisstock JC, Trapani J a (2015). Perforin and granzymes: function, dysfunction and human pathology. Nat Rev Immunol 15: 388–400.
- Wiedemann A, Depoil D, Faroudi M, Valitutti S (2006). Cytotoxic T lymphocytes kill multiple targets simultaneously via spatiotemporal uncoupling of lytic and stimulatory synapses. Proc Natl Acad Sci U S A 103: 10985–90.
- Zheng X, Halle S, Yu K, Mishra P, Scherr M, Pietzsch S, et al. (2016). Cardiomyocytes display low mitochondrial priming and are highly resistant toward cytotoxic T-cell killing. Eur J Immunol 46: 1415–26.