Qu'est-ce que la désextinction ? Comment ressusciter une espèce disparue ? Et quelles questions cette éventualité soulève ?
Tyrannosaurus rex a commencé à déambuler dans les plaines d’Amérique du Nord il y a 68 millions d’années (au Crétacé supérieur) [1]. Ce carnivore était un géant à l’âge adulte : 12 m de long, 4 m de haut pour une masse d’environ 6 tonnes. Ses longues jambes postérieures contrastaient avec ses petits bras, si courts qu’ils n’atteignaient même pas sa bouche. Celle-ci, armée de longues dents, était ancrée dans une tête massive. Son corps, incliné vers l’avant du fait de sa masse, était probablement couvert de protoplumes formant un manteau discontinu. Le T. rex a disparu lors de la crise Crétacé-Tertiaire il y a 65 millions d’années, comme la plupart des dinosaures.
Ce prédateur fascinant est connu à travers les fossiles, plutôt nombreux. Mais les fossiles ne bougent pas, ne mangent pas, n’interagissent pas entre eux… Si l’anatomie du T. rex est bien connue, on ne peut donc pas en dire autant de sa physiologie et de son écologie. Et s’il était possible d’en observer un vivant, alors ? C’est le but de la désextinction.
Qu’est-ce que la désextinction ?
La désextinction, ou résurrection d’espèces, consiste à produire un représentant vivant d’une espèce disparue. Cette volonté a émergé avec les disparitions d’animaux dont les Hommes ont été témoins depuis le XVIIe siècle, du dodo à l’ours des Pyrénées en passant par le loup de Tasmanie. Que ce soit par intérêt scientifique ou par culpabilité, les Hommes ayant souvent été la cause de ces disparitions, les biologistes cherchent depuis le début du XXe siècle un moyen de faire revivre des espèces anciennes.
Bien avant l’amélioration des connaissances en biologie moléculaire, les tentatives de désextinction ont commencé [6]. Par exemple, dans les années 1920, en sélectionnant des vaches au pelage sombre, aux cornes pointues et au tempérament farouche, une population d’individus proches des aurochs a été reconstituée par les frères Heck, en Allemagne. Le mot est important : il s’agit d’une reconstitution d’espèces, et non pas d’une désextinction à proprement parler. Les « aurochs » obtenus pouvaient encore être croisés avec les populations de vaches dont ils étaient issus, et possédaient le même caryotype. Ces aurochs étaient donc en réalité une simple race de vaches. L’élevage sélectif mené sur peu de générations ne permet pas de donner naissance à une nouvelle espèce.
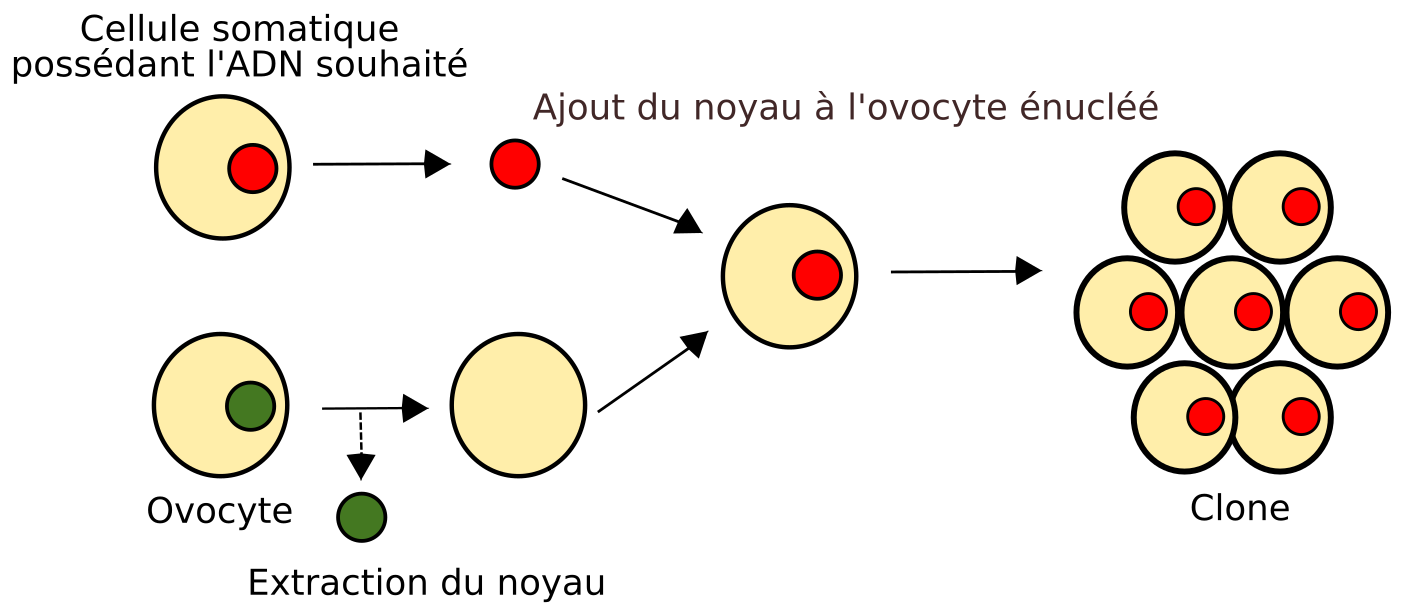
Une deuxième méthode prometteuse est apparue dans les années 70 : il s’agit du clonage. Un clonage réussi reformerait bien une espèce ancienne d’un point de vue génétique, et on pourrait alors parler de désextinction. Au lieu de prendre le noyau d'une cellule de l’organisme à cloner comme c’est le cas sur le schéma ci-dessous (noyau rouge), l’ADN reconstitué est directement injecté dans l’ovocyte (jaune).
Cependant, l’ADN reste le nœud du problème. Les échantillons d’ADN anciens sont rares et souvent mal conservés, avec des lacunes. Le génome du mammouth, par exemple, a été reconstitué en comblant les trous qui subsistent par comparaison avec le génome des éléphants actuels, leurs plus proches cousins. Des erreurs ont probablement été commises. Un mammouth ainsi reconstitué aurait donc un génome très proche du génome de son espèce, mais la ressemblance serait-elle suffisante pour considérer que l’on a bien affaire à l’espèce ancestrale, ou faudrait-il considérer ce mammouth comme le premier représentant d’une nouvelle espèce ? Cette question est sujette à débat.
Par ailleurs, les animaux clonés meurent prématurément et sont très difficiles à obtenir. Cette voie est pour l’instant une impasse, d’où la nécessité de changer de méthode. La troisième et dernière technique en date tire profit du nouvel et très puissant outil d’édition génétique mis au point depuis 2012 : la technologie CRISPR/Cas9. Dans un objectif de désextinction, cette technique permettrait de modifier le génome d’une espèce vivant actuellement, de sorte à obtenir celui d’une espèce ancienne.
Le clonage, tout comme l’utilisation de CRISPR/Cas9, ne permettrait que d’obtenir des individus génétiquement équivalents aux représentants de l’espèce ancienne, et seul le clonage aboutirait à un génome identique. Le nouvel individu ne serait pas élevé au sein de sa propre espèce, mais par une mère adoptive appartenant à une espèce proche. Il grandirait en captivité. Ainsi, certains traits de son comportement, non inscrits dans ses gènes, ne pourraient pas être les mêmes que ceux des individus disparus de son espèce. Au niveau des interactions sociales, des déplacements, de la recherche de nourriture, de la chasse ou de la fuite, les comportements anciens seraient impossibles à retrouver à l’identique. De même, le microbiote (l’ensemble des bactéries non pathogènes vivants sur un individu, dans son intestin, sa bouche, sur sa peau…) de ce nouvel individu ne pourrait être que différent, vu que les communautés microbiennes d’aujourd’hui ne sont pas les mêmes que celles qui existaient il y a plusieurs milliers ou millions d’années. Étant donné qu’il conditionne le régime alimentaire des individus, influence leur comportement et leur système immunitaire (entre autres), il est impossible de faire revivre une espèce ancienne à l’identique de ce qu’elle a été.
Le terme de désextinction est donc une idéalisation de ce qu’il est techniquement possible de réaliser. Une espèce ancienne ne pourra pas être ressuscitée. Mais une nouvelle espèce très proche peut être créée : très proche physiquement, mais aussi physiologiquement ou écologiquement (c’est-à-dire occupant une place similaire à l’espèce ancienne au sein de l’écosystème dont elle fait partie). Dans un sens plus large, le terme de désextinction désigne donc la génération d’un individu possédant les caractères d’une espèce disparue.
Pourquoi utiliser CRISPR/Cas9 pour ressusciter une espèce ancienne ?
CRISPR/Cas9 est une technologie d’édition du génome, qui permet de cibler précisément une séquence de l’ADN, longue d’une dizaine de nucléotides, et de la supprimer ou de la remplacer. Étant donné que les oiseaux sont les plus proches parents actuels du T. rex, CRISPR/Cas9 pourrait servir à modifier l’ADN des oiseaux de sorte à reconstruire l’ADN du T. rex. Cela se fait dans un embryon, au stade une cellule, afin que toutes les cellules de l’organisme soient génétiquement modifiées. L’individu qui éclot dix jours après la ponte est alors un OGM, un oiseau génétiquement modifié. Mais il en est tellement différent qu’il s’appelle T. rex, si la désextinction est réussie.
L’oiseau choisi pour être transformé en T. rex doit répondre à plusieurs critères. Premièrement, le but étant de modifier son génome, celui-ci doit donc être complètement séquencé ; ou alors le manipuler équivaudrait à opérer en aveugle. Deuxièmement, cet oiseau doit aussi être facilement manipulable dans un laboratoire. Il ne faut pas qu’il soit trop grand, comme une autruche, ou qu’il ait des serres acérées, comme un aigle. Troisièmement, il doit se reproduire facilement et rapidement en captivité, car il faut beaucoup d’embryons pour travailler à la réalisation d’un dinosaure. Le succès ne sera pas atteint en une fois. Un choix évident est donc le poulet Gallus gallus. Il est le modèle aviaire le plus utilisé dans les laboratoires. Son développement embryonnaire a été très étudié, et son génome est complètement séquencé.
Comment modifier le génome du poulet ?
Les mutations touchant les gènes sont souvent létales. Une modification de la séquence codante peut aboutir à un changement de structure de la protéine qui peut abolir sa capacité à accomplir sa fonction. Les mutations des séquences dites cis-régulatrices, en revanche, ont un fort potentiel évolutif. Situées en amont ou en aval des gènes, ces séquences contrôlent leur expression en augmentant ou diminuant la fréquence du démarrage de la transcription. Elles permettent l’expression de gènes spécifiques dans un type cellulaire donné et sont souvent redondantes (plusieurs séquences activent le même gène dans la même fenêtre spatio-temporelle). Ainsi, la mutation d’une telle séquence peut entraîner un gain ou une perte de fonction sans perturber les réseaux de régulation existants.
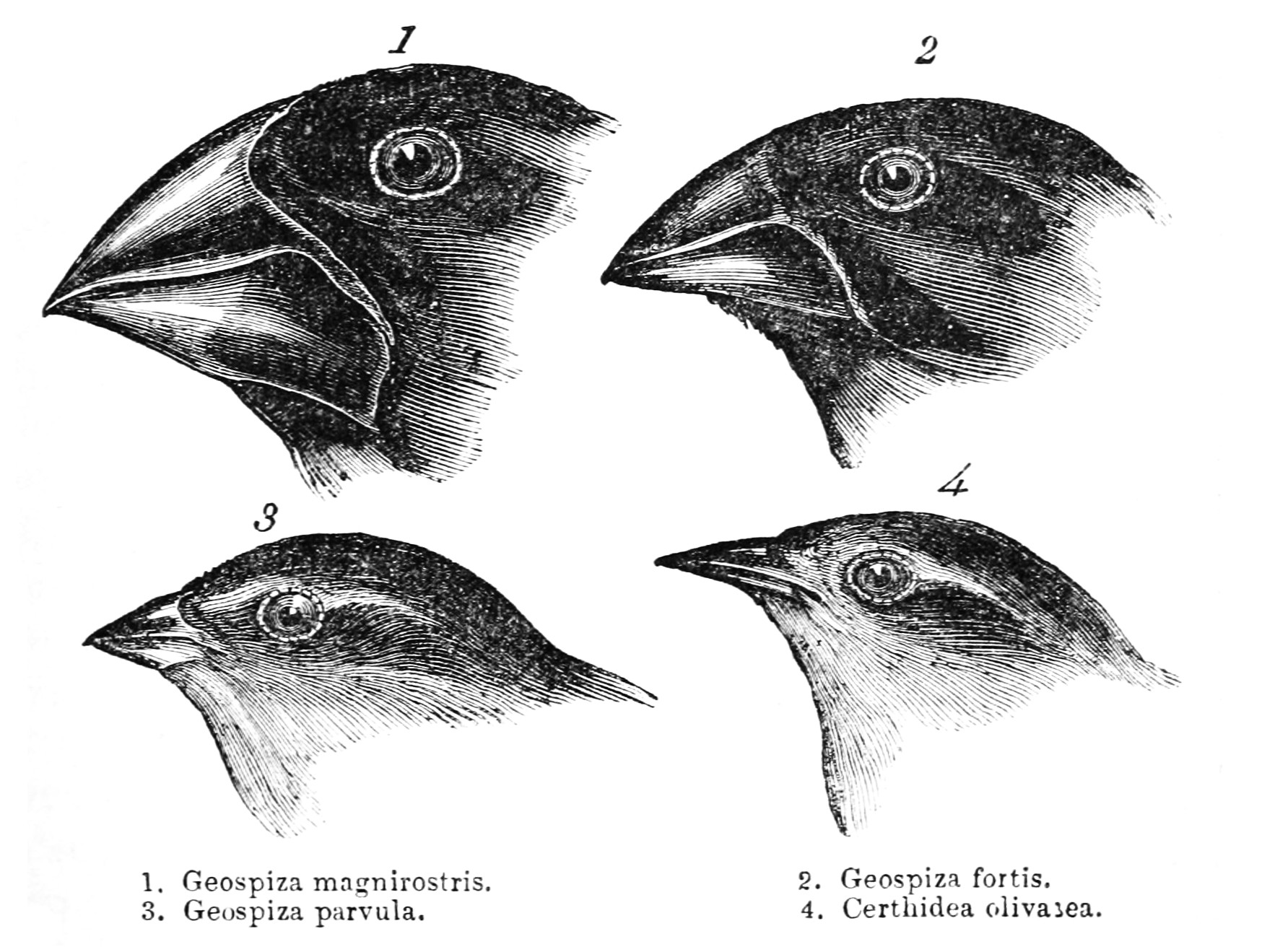
Alors, comment modifier le corps des organismes ? Chez l’adulte, cela est impossible : on ne peut pas retirer un doigt ou faire pousser un bras en modifiant génétiquement un individu adulte. Il faut donc agir au moment de la construction du plan d’organisation, c’est-à-dire pendant le développement embryonnaire. C’est au tout début de la vie d’un nouvel individu que les gènes de développement s’expriment, donnant à chaque cellule sa place dans l’organisme ainsi que son identité : cellule du foie, neurone… Ils contrôlent la taille des organes, en stimulant ou stoppant les divisions cellulaires. L’exemple des pinsons de Darwin illustre parfaitement ce phénomène : selon le moment, le lieu et la durée d’expression des gènes maîtres du développement du bec, les formes diffèrent selon les espèces alors que les mêmes gènes sont exprimés.
Sachant cela, voici la liste, non exhaustive de caractères à modifier pour passer du poulet à un animal ressemblant au T. rex (ci-dessous) :
- faire pousser une queue
- faire pousser des dents
- remplacer les ailes par des mains
- augmenter la taille globale
- réduire la quantité et la taille des plumes
Pour obtenir ces changements phénotypiques, il faut modifier le génotype du poulet. La plupart de ses gènes sont partagés avec le T. rex, mais dans une version un peu différente. Des substitutions de nucléotides, des gains ou pertes de séquences régulatrices par exemple, séparent deux gènes orthologues (similaires chez deux espèces différentes). Certains gènes présents chez l’ancêtre commun des deux espèces peuvent être devenus des pseudo-gènes, et ne sont donc plus exprimés dans une des espèces ; d’autres gènes sont apparus ou ont disparu. Mais étant donnée la faible distance évolutive entre ces deux espèces, ces derniers cas sont probablement minoritaires. Les séquences régulatrices des gènes peuvent aussi différer. Ainsi, un caractère peut être modifié ou perdu non pas parce que le gène responsable de ce caractère n’est plus fonctionnel, mais parce qu’il n’est plus exprimé. Les différences morphologiques observées entre poulet et T. rex peuvent notamment être dues à une expression différentielle des gènes de développement. Pour la même raison, les poulets n’ont pas de dent, alors que les T. rex en avaient (les données fossiles en attestent). Mais la pousse des dents a déjà été observée chez des embryons de poulet mutants, et elle se déroule de la même manière que chez les alligators
Les dents des alligators et des poulets sont donc homologues, elles ont la même origine évolutive. Ce mode de formation des dents serait présent chez tous les Archosauriens, famille dont font partie les oiseaux, les crocodiliens et les dinosaures non-aviaires. Le même processus était donc très probablement à l’œuvre dans les embryons de T. rex.
Chez le poulet, la mutation permettant d’observer un début de développement des dents conduit à la mort des embryons deux semaines après la fécondation. Avant cela, les territoires d’expression de différents gènes de développement peuvent être déterminés par hybridation in situ.
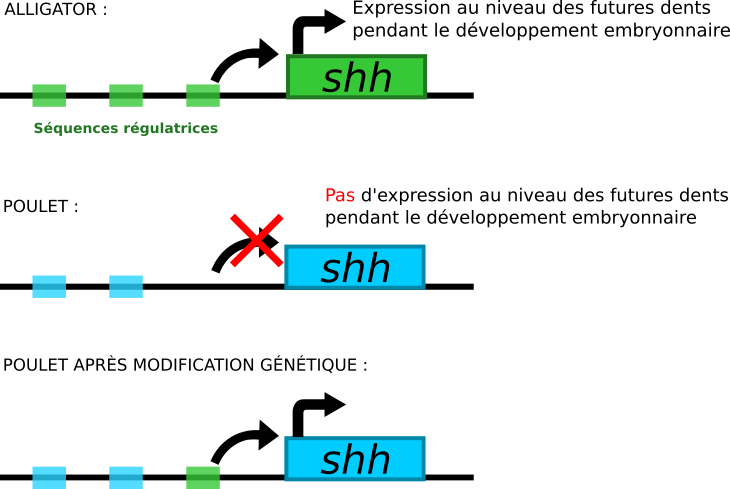
En particulier, le facteur de transcription Shh (Sonic hedgehog) n’est pas présent au même endroit chez le poulet mutant et chez le poulet sauvage. Cette différence de localisation de la protéine Shh est due à une modification d’une des séquences activatrices du gène ssh chez le poulet mutant. Pour obtenir un poulet à dents, il faut modifier cette séquence activatrice dans le génome du poulet. Mais, pour ne pas tuer l’embryon en reproduisant le même phénotype que chez le mutant, il faut confiner l’expression de shh au territoire voulu et la limiter dans le temps. Étant donné que cette molécule est exprimée « au bon endroit » et « au bon moment » chez les alligators, il serait possible d’utiliser leur(s) séquence(s) régulatrice(s), qu’il faudrait d’abord identifier.
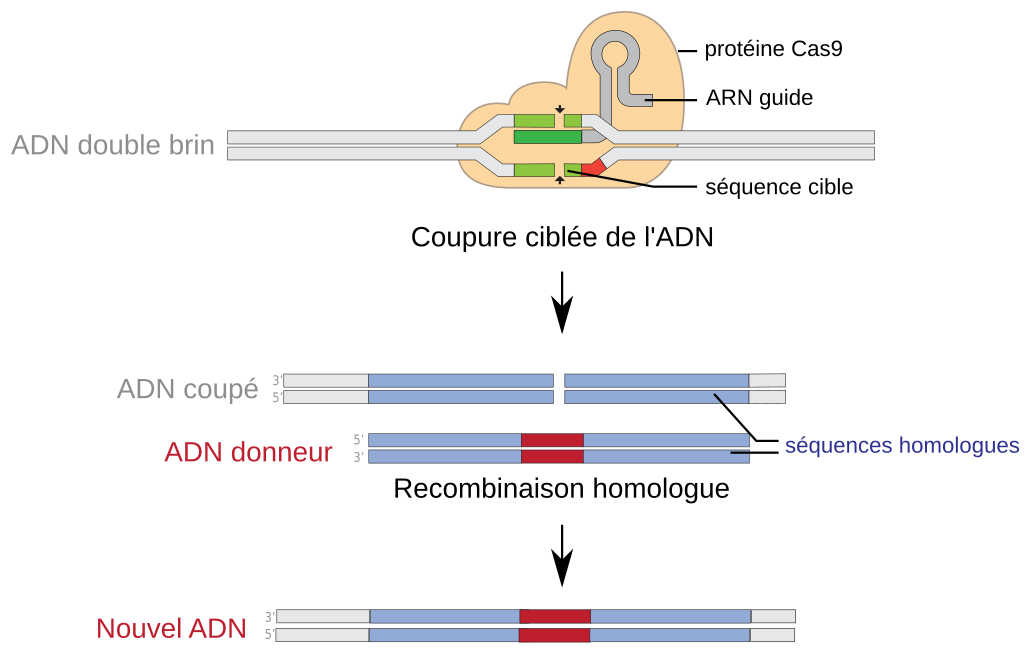
La technologie CRISPR/Cas9 permet d’éditer le génome de cette manière. Il faut injecter dans un embryon de poulet au stade une cellule :
- un ARN guide ;
- une protéine Cas9, préalablement associée à l’ARN guide ;
- un plasmide avec une séquence activatrice de l’expression de ssh, extraite de l’ADN d’alligator.
L’ARN guide (1) sera lié à la protéine Cas9 (2). Il reconnaîtra une région d’environ dix nucléotides présente en amont de sh h dans le génome du poulet. La nucléase Cas9 coupera cette séquence. La machinerie cellulaire de réparation de l’ADN entrera alors en action. Or, dans le plasmide (3), la séquence activatrice de s hh est entourée de séquences identiques à celles qui encadrent le site de coupure : la réparation s’effectuera donc par recombinaison homologue. Cette voie de réparation cellulaire aboutira à l’insertion de la séquence activatrice au niveau du site de coupure.
Quand ouvrira Jurassic Park ?
Peut-être jamais, et certainement pas demain ; car dé-éteindre une espèce de manière durable est encore hors de portée de la technologie humaine.
Tout d’abord, dans le cas du T. rex, le peu d’ADN disponible rend compliquée l’identification des changements à apporter au génome du poulet. Les séquences connues sont déduites de séquences protéiques, obtenues à partir d’échantillons anciens. L’ADN de fragments aussi vieux ne peut être extrait et séquencé ; une des seules études à avoir dit extraire de l’ADN de dinosaures a été remise en cause par la suite [3]. L’ADN séquencé provenait probablement d’une contamination de l’échantillon.
Même quand les séquences des génomes complets sont utilisables, le nombre de changements à apporter rend le projet extrêmement difficile. Par exemple, le mammouth et l’éléphant d’Asie présentent 1,4 millions de nucléotides différents. La technologie CRISPR/Cas9 ne permet pas de cibler de larges régions du génome. Elle est très efficace pour induire des délétions de quelques nucléotides, mais en modifier autant nucléotides représente un travail colossal et chronophage.
Enfin, la modification extensive du génome d’un animal aura sûrement des conséquences imprévues, sur sa viabilité notamment. Les gènes sont souvent pléiotropes, c’est-à-dire qu’ils remplissent plusieurs fonctions parfois très différentes. Nous ne les connaissons pas toutes. Les séquences régulatrices également sont encore mal connues. Enfin, plusieurs gènes sont souvent impliqués dans la construction d’un caractère et modifier l’expression d’un seul ne suffira probablement pas à obtenir le phénotype voulu. Par exemple, dans le cas des dents, les gènes fgf8 et bmp4 agissent de concert avec ssh2. Il faudrait peut-être les modifier également pour obtenir un poulet à dents. De telles tentatives de désextinction seront donc longues à aboutir, si elles aboutissent un jour.
Toutefois, un projet de désextinction utilisant CRISPR/Cas9 est déjà en cours actuellement : une équipe de l’université d’Harvard travaille à ressusciter le mammouth laineux à partir de l’éléphant d’Asie [5]. Les chercheurs ont modifié le génome en quatorze points. Leur but est de restaurer les caractères typiques du mammouth laineux chez l’éléphant d’Asie : couche de graisse sous-cutanée, longs poils, petites oreilles et hémoglobine adaptée au froid. Le Pleistocene Park en Arctique ouvrira probablement avant Jurassic Park.
Pourquoi ressusciter une espèce disparue ?
Tout d’abord, il s’agirait d’un exploit scientifique, enrichissant pour la recherche fondamentale. L’observation d’espèces anciennes apporterait de nouvelles connaissances sur leur physiologie, leur comportement et leur évolution. Dans le cas des plantes, de nouvelles substances pharmacologiques pourraient être découvertes. La recherche appliquée, par le développement de nouvelles techniques de génie génétique notamment, bénéficierait également d’un projet de désextinction.
Dé-éteindre une espèce représente néanmoins un fort investissement en temps et en argent : cela nécessite donc de sérieuses justifications. À l’université d’Harvard, le projet de créer un « mammophant », un éléphant d’Asie avec des caractères de mammouths, a pour objectif de relâcher ces nouveaux animaux dans la toundra. Par le piétinement, ils maintiendraient la couche herbeuse et empêcheraient la fonte du pergélisol (partie du sol gelée en permanence), un important réservoir de CO2. Ils aideraient ainsi à limiter le réchauffement climatique.
Mais d’un point de vue écologique, une telle réintroduction pourrait grandement perturber les écosystèmes actuels. D’une part, nous n’avons aucun moyen de connaître précisément la composition et le fonctionnement d’un écosystème ancien. D’autre part, depuis, il a été remplacé par un autre écosystème, qui n’est pas forcément moins valable que le premier. Si le mammouth, par exemple, est réintroduit, ce sera forcément au détriment d’autres espèces. Elles devront lui céder une partie des ressources de l’écosystème. Cela pourrait éventuellement causer d’autres disparitions. Même s’il était possible de les dés-éteindre aussi, entrer dans un tel cercle vicieux serait-il vraiment utile et nécessaire ? Un second risque écologique serait la diffusion facile de pathogènes par ces nouveaux animaux, ou la ré-apparition de virus, dont l’ADN serait encore intégré au génome utilisé pour cloner un représentant d’une espèce disparue.
Plusieurs questions de législation concernant les nouvelles espèces se posent également. Premièrement, si elles sont ré-introduites, les populations ne compteront au départ qu’un très petit nombre d’individus. Doivent-elles alors être considérées comme des espèces menacées ? Si oui, pour combien de temps ? Sans aucune protection, on peut s’attendre à ce qu’elle disparaisse une seconde fois. Mais il n’y a pas d’institution naturellement désignée pour les protéger : ce pourrait aussi bien être l’État dans lequel elle est ré-introduite, ou une de ses divisions administratives ; mais ce pourrait tout autant être l’entreprise ou l’institut scientifique qui l’a ressuscitée ; ou encore une instance internationale, si l’espèce est considérée comme appartenant au patrimoine mondial. De plus, si une partie des fonds alloués à la protection animale doit être détournée au profit de nouvelles-anciennes espèces, les animaux aujourd’hui menacés d’extinction risquent d’en pâtir. Ils pourraient aussi souffrir d’une dédramatisation de leur disparition, qui ne serait plus irréversible. Deuxièmement, la nouvelle espèce pourrait-elle être protégée par un brevet et n’appartenir qu’à une entreprise ? En ce cas, on pourrait imaginer que ses représentants vivent dans un espace contrôlé, qu’il faille payer pour les observer, qu’en diffuser une photo nécessite de verser des droits de diffusion à la compagnie propriétaire ; entre autres choses.
Enfin, se pose la question du respect animal. Le clonage génère des souffrances physiques : la brebis Dolly, premier mammifère cloné, souffrait d’arthrite et de difficultés respiratoires, et a vieilli précocement. D’autres animaux meurent quelques minutes après leur naissance, tel que l’unique bouquetin des Pyrénées dé-éteint [6]. Produits en laboratoire, ils ne connaissent bien souvent que la vie dans un zoo ; et étant les seuls de leur espèce, ne peuvent interagir avec des congénères. La douleur n’est donc pas forcément que physique : elle peut aussi être psychologique. Les animaux sauvages se reproduisent souvent difficilement en captivité, ce qui signale un mal-être de ces animaux. En créer pour les garder dans des zoos plaît plus aux Hommes qu’aux animaux. De plus, la biologie du nouvel animal étant inconnue, personne au départ ne connaîtra ses besoins spécifiques et ne pourra s’en occuper correctement. Enfin, le bien-être de la mère porteuse, dans le cas du clonage, ou de la mère naturelle, dans le cas de l’édition génétique, doit être pris en compte. La vie en laboratoire d’une part, la naissance d’une progéniture étrange d’autre part, peuvent induire un mal-être psychologique. Avant de tenter des approches de désextinction, il faut réfléchir au rapport coût-bénéfices : l’intérêt, l’utilité de la démarche sont-ils assez grands pour justifier l’utilisation des animaux ?
Conclusion
Créer un T. rex, pour quoi faire ? Là est la question. Les progrès technologiques rendent ce rêve de plus en plus réalisable. Les enjeux éthiques soulevés par cette possibilité sont les suites logiques de débats plus généraux qui agitent l’espace public, tels que la question de la souffrance animale ou les problématiques environnementales. Le dialogue entre la science et la société s’avère crucial pour répondre à des problématiques telles que la désextinction.
Bibliographie
- Switek, B. Palaeontology : The truth about T. rex. Nature 502, 424–426 (2013).
- Harris, M. P., Hasso, S. M., Ferguson, M. W. J. & Fallon, J. F. The Development of Archosaurian First-Generation Teeth in a Chicken Mutant. Curr. Biol. 16, 371–377 (2006).
- Hedges, S. B. & Schweitzer, M. H. Detecting dinosaur DNA. Science 268, 1191–1192 ; author reply 1194 (1995).
- Callaway, E. Mammoth genomes hold recipe for Arctic elephants. Nature 521, 18–19 (2015).
- Shapiro, B. Mammoth 2.0 : will genome engineering resurrect extinct species ? Genome Biol. 16, 228 (2015).
- Friese, C. & Marris, C. Making De-Extinction Mundane ? PLoS Biol. 12, (2014).