Cet article fournit les explications permettant de distinguer les phénomènes de glycosylation et de glycation, à l'échelle moléculaire. Il présente également le contexte physiologique dans lequel se déroulent ces deux réactions et notamment l'implication de la glycation dans le diabète et le vieillissement.
Introduction
La glycosylation et la glycation sont deux phénomènes qui, comme le suggèrent leurs noms, ont un rapport avec les glucides. Cette proximité sémantique et chimique peut parfois entraîner une certaine confusion, alors même que ces deux phénomènes sont chimiquement et fonctionnellement très différents.
Au sens large, la glycation correspond à « toutes les réactions fixant un sucre à une protéine ou à un peptide, qu’ils forment ou non une liaison glycosidique. Le produit de la glycation est une glycoprotéine » (voir Références).
Cependant, on distingue la glycosylation ou glycation enzymatique, phénomène physiologique donnant naissance aux glycoprotéines, et la glycation au sens strict ou glycation non-enzymatique, phénomène pathologique donnant naissance aux protéines glyquées.
La glycosylation
La glycosylation correspond à un ajout d’oligosaccharides (polymères constitués d’un petit nombre de glucides simples ou oses) au cours de la biosynthèse de certaines protéines membranaires ou secrétées, qui, de fait, deviennent des glycoprotéines. Cet ajout se fait par voie enzymatique et en plusieurs étapes dans le réticulum endoplasmique et l’appareil de Golgi des cellules Eucaryotes. Elle participe à la maturation de ces protéines et peut avoir un rôle décisif dans leur fonction.
On distingue deux grandes catégories de glycosylation : la N-glycosylation et la O-glycosylation, selon les acides aminés qui vont porter ces arbres glucidiques.
La N-glycosylation
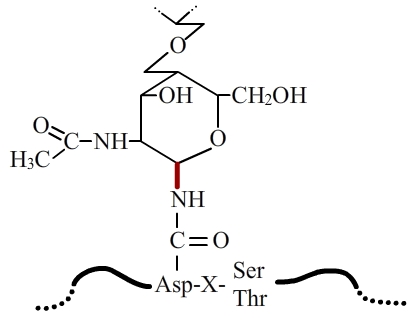
Dans la N-glycosylation, la liaison entre la protéine et l'arbre glucidique se fait entre la chaîne latérale d'un résidu asparagine et une N-acétylglucosamine. Cette liaison est appelée N-glycosidique (en rouge).
La N-glycosylation s’effectue en deux étapes. Dans un premier temps, une chaîne ramifiée de quelques oses est ajoutée cotraductionnellement sur la protéine à modifier, via l’établissement d’une liaison covalente entre un hydroxyl (-OH) d’une N-acétylglucosamine située à une extrémité de la chaîne glucidique, et l’amide (-CO-NH2) de la chaîne latérale d’un résidu asparagine appartenant à la protéine (fig. 1). La liaison ainsi formée est une liaison dite N-glycosidique, d’où le nom de N-glycosylation.
La réaction établissant cette liaison covalente est contrôlée par une enzyme, une glycosyltransférase, qui est localisée dans la lumière du reticulum endoplasmique. En effet, l’arbre glucidique est initialement porté par un dolichol, un lipide spécifiquement présent à la face interne de la membrane du reticulum endoplasmique. Il est alors transféré par la glycosyltransférase sur la chaîne polypeptidique en cours de synthèse. Les ribosomes, responsables de la biosynthèse des protéines, se trouvant dans le cytoplasme, cela suppose que la chaîne polypeptidique a traversé la membrane du réticulum endoplasmique pour être accessible à l’enzyme. C’est pourquoi la N-glycosylation ne concerne que les protéines membranaires ou secrétées, qui ont en commun de devoir franchir cette membrane, au moins pour une partie de la protéine.
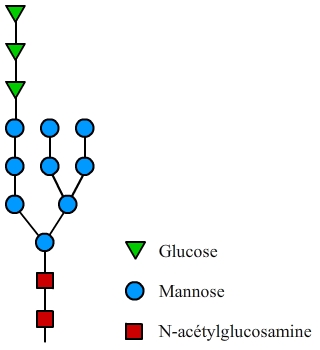
L’arbre glucidique initial de la N-glycosylation est greffé cotraductionnellement sur les protéines dans le réticulum endoplasmique. Il est constitué par 14 oses, dont 9 mannoses. Cet arbre sera plus ou moins modifié lors de la maturation des protéines dans l’appareil de Golgi.
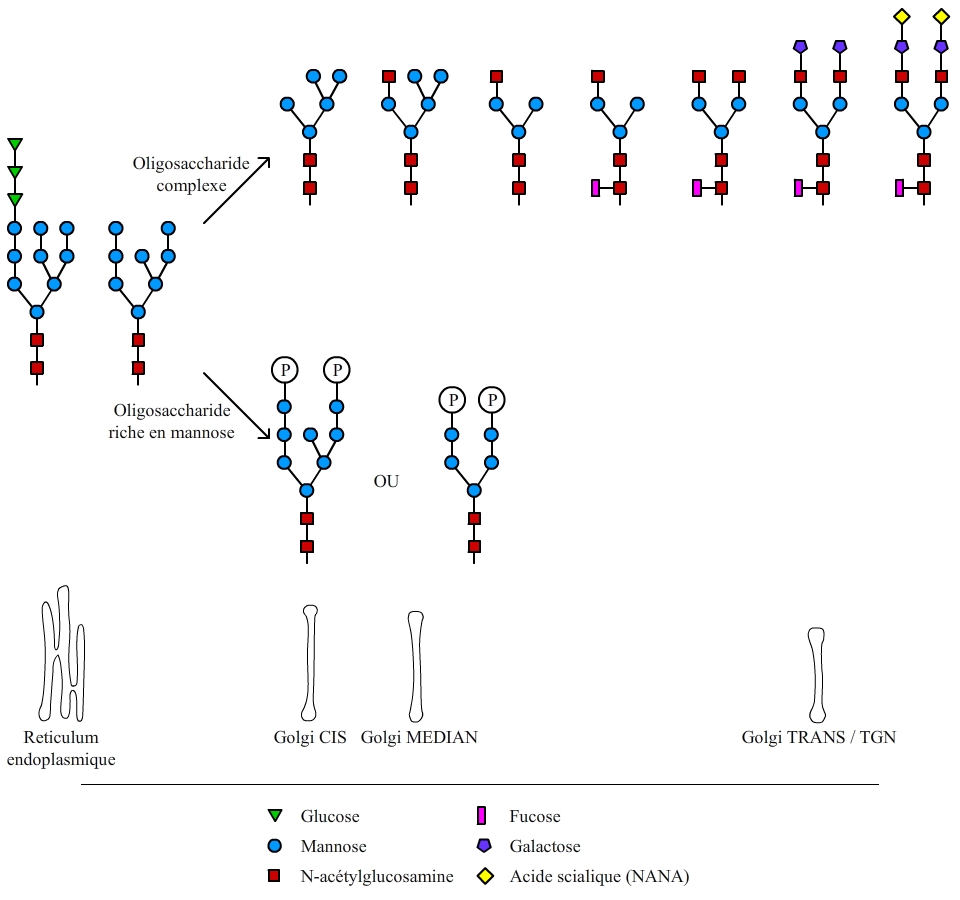
La chaîne glucidique initialement greffée est composée de 14 oses au total (fig. 2). Cet arbre glucidique initial est ensuite remanié lors du passage de la protéine par l’appareil de Golgi. Les modifications se font séquentiellement dans les compartiments successifs de l’appareil de Golgi (cis, médian, trans, et enfin réseau trans-golgien). Les principales modifications effectuées sont présentées dans la fig. 3.
Il existe deux grands types de maturation de l’oligosaccharide initial greffé sur les protéines. La première voie conduit à un oligosaccharide riche en mannose. Ce type de maturation se déroule pour les protéines qui vont rejoindre les lysosomes. L’autre voie conduit à un oligosaccharide dit complexe. Ce type de maturation se déroule pour les protéines membranaires ou secrétées. Dans ce cas, le dernier ose greffé est un acide sialique ou NANA (N-Acetylneuraminic acid) et la greffe s’effectue dans les compartiments les plus distaux de l’appareil de Golgi (trans et réseau trans-golgien ou TGN, pour Trans Golgi Network). La sialylation des protéines est ainsi couramment utilisée comme marqueur de traversée complète de l’appareil de Golgi.
L’addition de chaînes glucidiques ne s’effectue pas sur tous les résidus asparagine des protéines N-glycosylées. En effet, seules les asparagines appartenant aux deux séquences Asn-X-Ser ou Asn-X-Thr (où X est un acide aminé quelconque excepté la proline) peuvent être glycosylées (fig. 1). Ces signaux, s’ils sont nécessaires, ne sont cependant pas suffisants et ne déterminent que des sites potentiels de N-glycosylation. D’autres facteurs entrent en jeu pour la glycosylation effective de ces sites, comme la structure de la protéine elle-même ou le type cellulaire dans lequel elle est synthétisée.
Les oligosaccharides portés par les glycoprotéines ont plusieurs fonctions qui passent le plus souvent par leur liaison à des lectines, c’est-à-dire des protéines ayant une affinité pour certains motifs glucidiques. C’est ainsi que ces oligosaccharides peuvent participer au repliement (acquisition de la structure tridimensionnelle) des glycoprotéines qui les portent. Pour cela, ils vont être reconnus par des lectines qui aident les protéines nouvellement synthétisées à se replier (protéines dites chaperon). Par la suite, ces motifs glucidiques étant généralement bien exposés à la surface des glycoprotéines qui les portent, ils participent en particulier à l’adhésion cellulaire en fixant, par des liaisons faibles, des lectines membranaires appartenant à d’autres cellules, ou des lectines possédant plusieurs sites de liaison pouvant assurer un pontage entre différentes glycoprotéines.
Comme souvent, on connaît des exemples de pathologies dans lesquelles ces oligosaccharides sont impliqués. L’un des exemples le plus commun est la grippe. En effet l’hémagglutinine, une protéine virale du virus de l’influenza responsable de la grippe, se lie aux acides sialiques des cellules qu’il infecte, ce qui provoque un changement de conformation de cette protéine et permet, in fine, l’entrée du virus dans la cellule.
La O-glycosylation
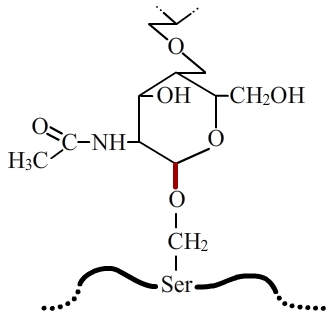
Dans la O-glycosylation, la liaison entre la protéine et l’arbre glucidique se fait entre la chaîne latérale d’un résidu serine ou thréonine (éventuellement hydroxylysine) et une N-acétylgalactosamine. Cette liaison est appelée O-glycosidique (en rouge).
La O-glycosylation correspond également à l’ajout d’un oligosaccharide sur une protéine, mais via l’établissement d’une liaison entre une N-acétylgalactosamine et le groupement hydroxyl (-OH) de la chaîne latérale d’un acide aminé sérine ou thréonine (fig. 4). Il existe cependant un cas particulier, celui du collagène, où le sucre impliqué dans la liaison est un galactose et l’acide aminé une hydroxylysine.
Cette addition se déroule dans l’appareil de Golgi, donc post-traductionnellement, durant la phase de maturation de ces glycoprotéines. Une fois encore, le mécanisme est contrôlé par voie enzymatique. En revanche, l’addition des résidus se fait séquentiellement un à un (s’il y en a plusieurs évidemment), à partir d’oses activés par leur liaison avec un nucléotide, et non à partir d’un précurseur oligosaccharidique.
Au final, les chaînes glucidiques de la O-glycosylation sont beaucoup plus courtes que dans le cas de la N-glycosylation, avec le plus souvent 1, 2 voire 3 résidus osidiques seulement. Pour autant les chaînes obtenues sont beaucoup plus variées que dans le cas de la N-glycosylation.
La glycation
La glycation est une réaction qui se produit entre un glucide et une protéine, conduisant à l’établissement d’une liaison covalente entre ces deux molécules. Cette réaction chimique se déroule spontanément dans l’organisme sans avoir besoin d’être accélérée par une enzyme. La vitesse de la réaction dépend de la concentration des deux espèces moléculaires, c’est pourquoi elle a été particulièrement étudiée dans le cas de personnes diabétiques (réaction favorisée par la concentration élevée en glucose dans le sang). Elle dépend aussi de la température : très rapide au-delà de 100 °C, elle reste non négligeable à 37 °C et non nulle, quoique lente, à 4 °C. Sur un temps long, cette réaction peut donc être importante et c’est pourquoi elle est aussi impliquée dans le vieillissement.
La glycation est une réaction de Maillard
D’un point de vue chimique, la glycation correspond à une réaction de Maillard entre un acide aminé et un saccharide. Cette réaction est particulièrement connue des amateurs de cuisine car c’est elle qui est responsable du brunissement des aliments, lorsqu’ils sont cuits à haute température, et contribue au goût des viandes rôties.
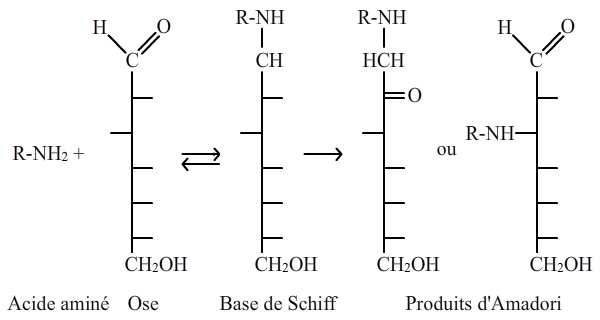
Dans un contexte biologique, on a, dans un premier temps, l’établissement d’une liaison covalente entre un NH2 d’un acide aminé libre ou inclus dans une chaîne polypeptidique, le plus souvent une lysine, et un carbonyle (acide carboxylique R-CO-OH, cétone R-CO-R' ou aldéhyde R-CO-H) d’un saccharide, qui est généralement du glucose, donnant naissance à une carbonylamine. Cette réaction initiale est suivie par des réarrangements connus sous le nom de réarrangements d’Amadori, donnant naissance à des produits d’Amadori (fig. 5). Enfin, les produits d’Amadori sont modifiés (déshydratations, clivages, etc.) aboutissant à la production d’AGE (Advanced Glycated End products) ou PTG (Produits Terminaux de Glycation) qui ont un rôle important dans le vieillissement (voir plus loin).
La réaction initiale entre une amine primaire et un carbonyle, avec déshydratation, est suivie par des réarrangements (dits d'Amadori). Les produits d'Amadori qui en sont issus évoluent avec le temps en AGE (Advanced Glycated End Products) ou PTG (produits terminaux de glycation) qui peuvent être de nature très variée.
Glycation et diabète
La vitesse de la réaction de glycation étant dépendante de la concentration en glucose, toutes choses égales par ailleurs, on conçoit aisément que la glycation de protéines sera plus importante chez les sujets diabétiques. L’une des protéines dont la glycation a été particulièrement étudiée est l’hémoglobine, qui, sous sa forme glyquée, est appelée HbA1c. De fait, on constate que l’hémoglobine d’une personne est d’autant plus glyquée que sa glycémie est élevée (fig. 6). Du coup, mesurer le taux de glycation de l’hémoglobine renseigne sur la glycémie moyenne des 2 à 3 mois précédents la mesure (la durée de vie des globules rouges qui contiennent l’hémoglobine étant de l’ordre de 120 jours). Cette mesure est donc complémentaire d’une mesure instantanée de la glycémie, qui peut être très variable chez un sujet présentant un défaut de régulation de cette grandeur.
| Valeur HbA1c en % | Glycémie moyenne en g.l-1 |
|---|---|
| 4 | 0,6 |
| 5 | 0,9 |
| 6 | 1,2 |
| 7 | 1,5 |
| 8 | 1,8 |
| 9 | 2,1 |
| 10 | 2,4 |
|
On constate qu'il existe une relation de proportionnalité entre les valeurs des deux grandeurs. Un objectif de glycémie moyenne peut ainsi être suivi par la mesure du taux de HbA1c. |
|
La glycation importante des protéines chez les sujets diabétiques est également responsable de certains des désordres liés à cette maladie chronique. C’est ainsi que la glycation des cristallines, protéines du cristallin très stables dans le temps, est responsable de l’opacification du cristallin en introduisant des pontages entre ces protéines. Ceci explique que la cataracte soit fréquemment associée au diabète.
Glycation et vieillissement
Les protéines ayant un taux de renouvellement (turnover) faible vont avoir le temps d’évoluer jusqu’au stade PTG. Or ces PTG vont entraîner différentes sortes de problèmes.
Tout d’abord ces PTG vont être à l’origine de pontages entre protéines, notamment du collagène, entraînant une diminution de l’élasticité des tissus. On peut citer comme conséquence le vieillissement de la peau.
On retrouve également des PTG circulants (notamment des lipoprotéines) qui sont reconnus par des récepteurs spécifiques (RAGE pour Receptor for Advanced Glycation Endproducts ou récepteur aux produits de glycation avancés, Galectin 3, etc.) présents sur de nombreuses cellules : cellules endothéliales des vaisseaux sanguins, monocytes, neurones, cellules musculaires lisses, fibroblastes, etc. Cette liaison entraîne différentes actions délétères : stress oxydatif (production de radicaux libres), augmentation de la perméabilité des vaisseaux, production de cytokines ou de facteurs de croissance, etc. avec pour conséquences des lésions vasculaires touchant notamment la rétine (rétinopathies liées à la production de Vascular Endothelium Growth Factor ou VEGF) ou le rein (insuffisance rénale).
Enfin les PTG produits à l’intérieur de la cellule (glycation intracellulaire) ont la particularité de ne pas être clivés par les protéasomes, ils ne peuvent donc pas être dégradés (voir le document « La voie de dégradation ubiquitine dépendante »), ni être évacués. Ces PTG vont donc progressivement s’accumuler dans les cellules, entraînant des désordres divers pouvant aller jusqu’à la mort cellulaire.
Les PTG apparaissent donc comme des acteurs majeurs du vieillissement, au même titre que les radicaux libres. Signalons que les PTG produits dans le corps ne sont pas les seuls à être mis en cause. Les apports alimentaires (les réactions de Maillard sont extrêmement courantes lors d’une cuisson au-delà de 120 °C) semblent également jouer un rôle important.
Conclusion
Glycosylation et glycation, hormis le fait qu’elles aboutissent dans les deux cas à la greffe de glucides sur des protéines, sont donc des mécanismes totalement différents. Réaction contrôlée par voie enzymatique ayant des rôles physiologiques importants dans un cas, réaction purement chimique conduisant à l’accumulation des molécules affectées dans l’autre cas.
La glycosylation et la glycation doivent également être différenciées des processus qui conduisent à la synthèse des protéoglycanes de la matrice extracellulaire. En effet, ceux-ci sont des molécules ayant un cœur protéique relativement petit mais portant de très longues chaînes glucidiques qui constituent la majorité de leur masse moléculaire. Ces molécules forment des agrégats très importants qui sont à la base de la matrice extracellulaire.
Enfin, d’autres mécanismes peuvent aboutir à la greffe de glucides sur d’autres types de molécules. Un cas particulièrement connu concerne le système ABO des groupes sanguins (voir l'article « Groupes sanguins et conséquences médicales »), qui correspond cette fois à la greffe de glucides sur des lipides.
Références
-
IUPAC-IUB Joint Commission on Biochemical Nomenclature, Eur. J. Biochem, 1986, 159:1-6. (voir le pdf)