Explication des différences entres les groupes sanguins.
Applications dans le domaine médical : transfusions sanguines et risque lors de la grossesse, pour les mères Rh− portant un enfant Rh+.
Introduction générale
Les globules rouges humains ou érythrocytes sont des cellules originales par bien des aspects de leur physiologie à commencer par une spécialisation fonctionnelle extrêmement poussée passant par la perte du noyau et donc de toute capacité de synthèse protéique de novo. Ces spécificités du fonctionnement érythrocytaire vont de pair avec un statut immunologique à part dans l’organisme, les globules rouges n’exprimant pas l’antigène tissulaire majeur commun aux autres types cellulaires, le complexe majeur d’histocompatibilité (CMH). Les globules rouges ne sont pas pour autant dénués d’identité immunologique et les graves accidents émaillant les premières transfusions sanguines réalisées à l’aveugle ont très tôt suggérés qu’il devait exister des marqueurs sanguins responsables de la compatibilité entre le sang de deux individus différents.
Ces marqueurs de compatibilité, ou antigènes érythrocytaires, sont aujourd’hui bien connus, ils permettent de définir les différents groupes sanguins. Les réponses immunitaires qu’ils induisent dans différentes situations physiologiques ou pathologiques sont elles aussi bien connues, cette connaissance permettant de prendre en charge au mieux les problèmes médicaux qu’elles peuvent soulever.
Des antigènes à la surface des globules rouges
Nature des antigènes de surface
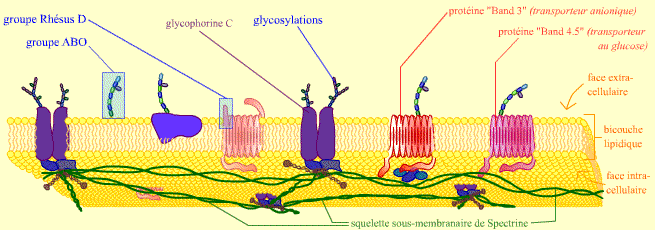
On trouve à la surface des globules rouges, ou érythrocytes, des molécules capables d’être reconnues par le système immunitaire et de déclencher une réponse immune. Ce sont les antigènes membranaires érythrocytaires. Leur nature chimique est variable : protéine, glycoprotéine (protéine + polysaccharide) ou glycolipide (lipide + oligo-polysaccharide). Il s’agit de transporteurs et canaux membranaires (protéines assurant les transports de molécules à travers la membrane), d’enzymes, de protéines structurales de la membrane (« charpente » du globule), de molécules d’adhérence ou de récepteurs membranaires (protéines capables de lier une molécule signal ou informative).
Cette membrane possède de nombreuses protéines membranaires, dont quelques exemples sont représentés.
Ces protéines servent de point d’ancrage à un important squelette sous-membranaire (formé de spectrine), qui donne sa forme au globule rouge.
On peut noter la présence de glycosylations importantes au niveau de la face extracellulaire, au contact du plasma.
Deux exemples d’antigènes membranaires sont présentés : les glycosylations (sur des lipides ou des protéines) du groupe ABO, et l’épitope protéique du groupe Rhésus D.
Variabilité inter-individuelle de certains antigènes
Certains de ces antigènes présentent une variabilité d’un individu à l’autre au sein de l’espèce humaine : on parle de polymorphisme. Cette variation porte, par exemple, sur certains acides aminés de la protéine, sur certains sucres ou la longueur du polysaccharide. Cette variabilité est le reflet de la variabilité génétique inter-individuelle portant sur les gènes codant les protéines en question ou ceux codant les enzymes responsables de l’agencement des polysaccharides.
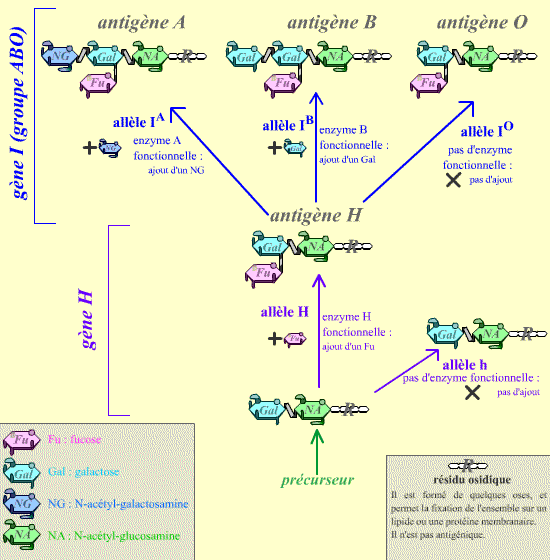
Le système ABO correspond à la présence, sur la membrane des hématies, de polysaccharides spécifiques.
Ces polysaccharides sont composés d’un résidu qui n’est pas antigénique, et de quelques sucres terminaux qui sont différents selon les antigènes.
Ces sucres sont associés par l’action successive des produits de deux gènes (H puis I) : les allèles présents chez un individu déterminent les types de réaction qui peuvent avoir lieu, et donc le type d’antigène présent sur les hématies.
| Génotype (allèles présents) | Phénotype | |||
| Gène H | Gène I | Enzymatique | Antigénique | |
| H , H
ou H , h |
IO , IO |
enzyme H fonctionnelle pas d'enzyme A ni B fonctionnelle |
O | 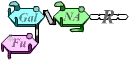 |
| IO , IA |
enzyme H fonctionnelle enzyme A fonctionnelle |
A | 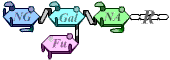 |
|
| IA , IA | ||||
| IO , IB |
enzyme H fonctionnelle enzyme B fonctionnelle |
B | 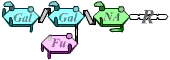 |
|
| IB , IB | ||||
| IA , IB |
enzyme H fonctionnelle enzymes A et B fonctionnelles |
A | 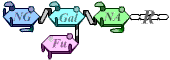 |
|
| B | 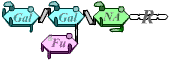 |
|||
| h , h | n'importe quelle combinaison |
pas d'enzyme H les enzymes A et B peuvent être ou fonctionnelles ou pas, mais elles n'ont pas de substrat, en l'absence d'antigène H... |
 |
|
| Ce phénotype, rare, est dénommé phénotype "Bombay" | ||||
Antigènes, systèmes antigéniques et groupes sanguins érythrocytaires
L’ensemble des variants antigéniques d’un composé membranaire constitue un système.
On a identifié à ce jour plus de vingt systèmes antigéniques érythrocytaires chez l’homme : système ABO avec les antigènes A ou B, système Rhésus avec l’antigène D (présent + ou absent -), E ou e, et C ou c, système Kell avec l’antigène K ou k, etc.
Les individus présentant une même association d’antigènes érythrocytaires appartiennent à un même groupe sanguin érythrocytaire. Les groupes sanguins sont d’autant plus complexes et nombreux que l’on utilise plusieurs systèmes antigéniques : 4 groupes dans le système ABO (A, B, AB, O), huit groupes si on ajoute le RhésusD (A+, B+, AB+, O+, A-, B-, AB-, O-), etc.
Certains antigènes sont exclusivement présents à la surface des globules rouges comme ceux du système Rhésus ; d’autres sont communs à plusieurs lignées cellulaires comme ceux du système ABO qui est donc aussi un système antigénique tissulaire (globule rouge, plaquette, endothélium vasculaire, foie, rein).
| Système | Phénotype antigénique | Génotype chromosomique | Fréquence (française) | Caractéristiques | Nature |
| ABO
(A, B) |
A | IA/IA ou IA/IO | 45 % | présence d'IgM naturelles régulières dirigées contre les antigènes non présents chez les individus. Il existe deux sous-types A (a1 et a2), sans conséquence immunopathologique |
polysaccharide |
| B | IB/IB ou IB/IO | 9 % | |||
| AB | IA/IB | 4 % | |||
| O | IO/IO | 42 % | |||
| Rhésus
(Rh +, C, c, E, e) |
+ | D/d ou D/D | les associations les plus fréquentes : DCe 42 % DcE 13 % dce 39 % |
Au locus Rhésus : 2 gènes homologues en tandem. Rhésus D & Rhésus CE L'anticorps anti-D est une des hémolysines les plus importantes en pathologie |
canal transporteur membranaire potentiel |
| - | d/d | ||||
| C, Cc c Ee, E, e |
Le gène Rhésus CE porte sur la même séquence les deux déterminants antigéniques C,c et E,e | canal transporteur membranaire potentiel | |||
| Kell
(K, k) |
+ | K/K ou K/k | 90 % | Système en réalité plus complexe, K correspondant à au moins 23 antigènes différents... Anticorps anti-K : fréquent et dangereux. Anticorps anti-k (anti-Cellano) : exceptionnel |
glycoprotéine à une traversée membranaire |
| - | k/k | 10 % | |||
| Duffy
(Fya, Fyb) |
Fya | codominance des allèles a et b | Certaines populations noires n'ont pas l'antigène Duffy, car n'expriment pas la protéine de base nommée AgFy3 | ||
| Fyb | |||||
| Fyab | L'antigène Duffy est la "porte d'entrée" de Plasmodium vivax dans les hématies | récepteur à des peptides chimiotactiques | |||
| Kidd
(Jka, Jkb) |
Jka | codominance des allèles a et b | Les allèles Jka et Jkb sont chacun présents dans environ 75 % de la population | L'anticorps anti-Jka est dit "perfide et dangereux", car très hémolytique et difficile à mettre en évidence | canal transporteur membranaire |
| Jkb | |||||
| Jkab | |||||
|
Au-delà des systèmes ABO et Rhésus, de nombreux autres systèmes existent. Ce tableau présente les systèmes Kell, Duffy et Kidd. D’autres systèmes moins fréquemment recherchés en pratique existent aussi (MNS, Lewis, etc.) |
|||||
| ABO | Rhésus D | Fréquence (%) |
| A | + | 38 |
| O | + | 36 |
| B | + | 8 |
| A | - | 7 |
| O | - | 6 |
| AB | + | 3 |
| B | - | 1 |
| AB | - | 1 |
À retenir
- La nature des antigènes érythrocytaires.
- La relation entre polymorphisme des antigènes et identité immunologique érythrocytaire.
- Le lien entre la notion de système antigénique érythrocytaire et celle de groupe sanguin érythrocytaire.
Des anticorps dans le sérum
Tolérance immunitaire des antigènes érythrocytaires du soi
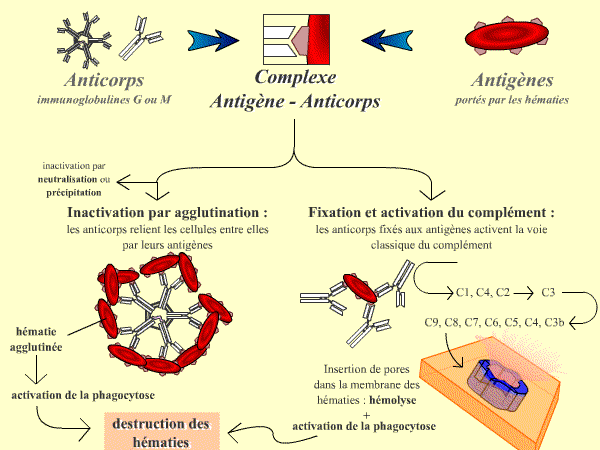
En réponse à ces antigènes érythrocytaires, le système immunitaire produit des anticorps spécifiques. En situation normale, le système immunitaire ne produit pas d’anticorps dirigés contre les antigènes appartenant au groupe sanguin de son propre organisme. Ces antigènes sont reconnus comme faisant partie du soi, ils ne déclenchent pas de réponse immunitaire.
Le dérèglement de cet équilibre peut conduire au développement d’une réponse immunitaire dite auto-immune de l’organisme contre ses propres globules rouges avec production d’un auto-anticorps dirigé contre un antigène érythrocytaire et que l’on peut retrouver dans le sérum des malades. Il s’agit d’une situation rare de maladie auto-immune qui peut être responsable d’une destruction des globules rouges ou hémolyse.
Nature, origine et propriété des anticorps anti-érythrocytaires circulants
En dehors de cette situation pathologique, le sérum d’un individu bien portant peut contenir deux types d’anticorps dirigés contre des antigènes érythrocytaires.
Les premiers types d’anticorps sont obligatoires (ou réguliers ou naturels) et dirigés contre les antigènes du système ABO absents chez l’individu (par exemple anticorps anti-A chez l’individu de groupe B).
Il s’agit d’immunoglobulines de type M (IgM), apparaissant naturellement entre 0 et 6 mois de vie, probablement par stimulation du système immunitaire par des antigènes de la flore bactérienne de l’organisme ressemblant aux antigènes du groupe ABO (mécanisme mal connu).
Ces anticorps sont capables d’agglutiner les globules rouges in vitro, c’est pourquoi on parle d’agglutinines.
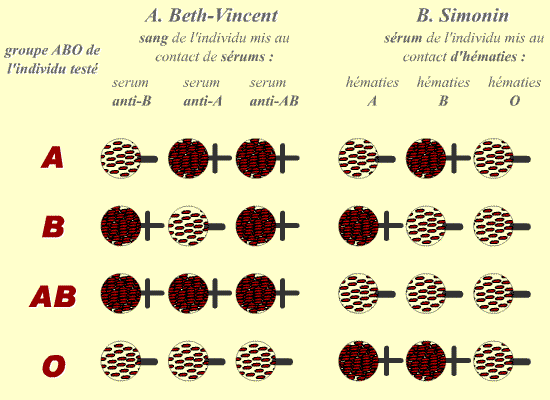
Le sérum d’un individu de groupe B agglutine donc les globules rouges d’un individu de groupe A : c’est ce phénomène qui est mis à profit pour déterminer le groupe ABO d’un individu par les épreuves de Beth-Vincent et Simonin. L’épreuve de Beth-Vincent permet de déterminer le phénotype antigénique d’un individu, c’est-à-dire les antigènes portés par ses globules rouges. L’épreuve de Simonin permet de réaliser l’étude complémentaire, c’est-à-dire de déterminer les anticorps circulants présents dans le sérum d’un individu.
A. Épreuve de Beth-Vincent. Le sang de l’individu, contenant ses globules rouges, est mis en présence de sérums tests, possédant chacun un type d’anticorps précis, dirigé contre un antigène du système ABO. Il s’agit donc d’un test d’agglutination des globules rouges avec des sérums tests.
B. Épreuve de Simonin. Le sérum de l’individu, contenant ses anticorps circulants, est mis en présence de globules rouges tests, appartenant chacun à un groupe antigénique précis du système ABO. Il s’agit donc d’un test d’agglutination du sérum avec des globules rouges tests.
+ = présence d’une agglutination.
- = pas d’agglutination.
À 37 °C, en particulier in vivo, ces IgM sont aussi capables de lyser les globules rouges par activation du complément sanguin (ensemble d’enzymes circulant dans le sang dont l’activation par les anticorps liés à leurs antigènes provoque la destruction des cellules porteuses de l’antigène). Les IgM sont de grosses molécules qui ne traversent pas le placenta au cours de la grossesse. Il arrive parfois, en particulier chez les individus du groupe O, que la commutation IgM vers IgG se produise, conduisant à la présence spontanée d’une IgG anti-A ou B dans le sérum. Ces IgG ont un fort pouvoir hémolytique ; c’est pourquoi on parle d’hémolysines.
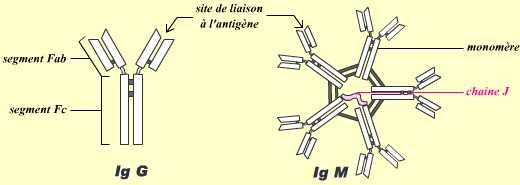
Les IgG sont des immunoglobulines monomériques, formées de quatre chaînes polypeptidiques reliées entre elles par des ponts disulfures. Elles possèdent deux sites de liaison à l’antigène.
Les IgM sont des immunoglobulines pentamériques, reliées entre elles par des ponts disulfures et un polypeptide (la chaîne J).
La reconnaissance d’un anticorps par les anticorps IgG et IgM permet à l’organisme de se défendre contre les cellules porteuses de cet antigène.
Les deux classes d’immunoglobulines peuvent activer la voie du complément, mais seules les IgM peuvent agglutiner les hématies : les IgM sont donc communément dénommées agglutinines, l’agglutination restant leur premier mode d’action, alors que les IgG, activant le complément, sont dénommées hémolysines.
Attention : ces représentations très schématiques ne sont pas à l’échelle !
Le deuxième type d’anticorps probablement présent dans le sérum est facultatif, ou irrégulier, dirigé contre des antigènes des systèmes non ABO. Il s’agit le plus souvent d’IgG ou hémolysines, apparaissant à l’occasion d’une stimulation antigénique par des globules rouges étrangers (par exemple suite à une transfusion), c’est pourquoi on parle d’anticorps immuns (par opposition à naturels). Ces anticorps montrent qu’il y a eu une réponse du système immunitaire vis-à-vis des globules rouges étrangers, ce sont les effecteurs de la réponse immunitaire humorale anti-érythrocytaire. Les IgG sont capables de traverser le placenta au cours de la grossesse.
À retenir
- La tolérance immunitaire des antigènes du groupe sanguin du soi.
- La notion d’anticorps naturel ou immun, régulier ou irrégulier.
- L’utilisation des propriétés agglutinantes des IgM ou agglutinines anti-A ou B dans les épreuves de Beth-Vincent et Simonin.
- Le fort pouvoir hémolytique des IgG anti-antigène érythrocytaire ou hémolysines.
- Le passage transplacentaire des IgG mais pas des IgM.
Incompatibilité fœto-maternelle : quand les mamans Rh− détruisent les globules rouges de leurs bébés Rh+
Tolérance immunitaire du fœtus au cours de la grossesse
Un enfant a une identité antigénique, portée par ses antigènes tissulaires (groupe tissulaire ou CMH, mais aussi ABO) et érythrocytaires (groupe sanguin), a priori différente de celle de sa mère. Les cellules fœtales sont donc susceptibles d’être reconnues comme étrangères (non-soi) par l’organisme maternel.
Au cours de la grossesse, des mécanismes immunologiques spécifiques assurent la tolérance du fœtus par le système immunitaire de la mère qui ne le rejette pas. En particulier, les anticorps naturels réguliers dirigés contre les antigènes du système ABO, et qui sont des IgM, ne traversent pas le placenta et ne sont jamais en eux-mêmes responsables de destruction de globules rouges fœtaux.
Passage transplacentaire de globules rouges fœtaux et réponse immunitaire maternelle
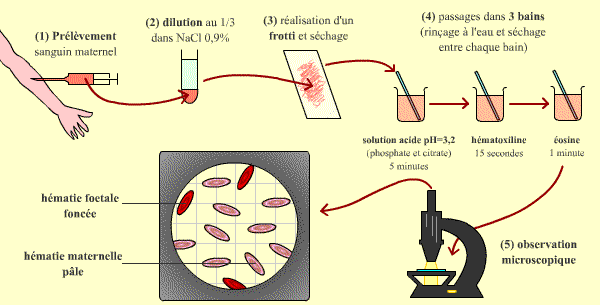
Au sein du placenta où s’effectuent les échanges nécessaires au développement du fœtus, les circulations sanguines maternelle et fœtale sont en contact intime. Cependant, il n’y a pas de contact direct entre le sang maternel et le sang fœtal qui ne se mélangent pas. À l’occasion de petits traumatismes du placenta ou des membranes placentaires (choc, ponction de liquide amniotique, etc.) et surtout lors de l’accouchement, des globules rouges fœtaux sont susceptibles de passer dans la circulation générale maternelle. Une réaction immunitaire maternelle dirigée contre les antigènes érythrocytaires fœtaux n’appartenant pas au groupe sanguin maternel peut alors se déclencher et conduire à la production d’hémolysines spécifiques de ces antigènes. Cette réaction est d’autant plus forte et fréquente que la quantité de globule rouges fœtaux passée dans la circulation maternelle est importante, mais aussi que les antigènes qui diffèrent entre la mère et le fœtus sont puissamment immunogènes. Cette quantité peut être appréciée par le test de Kleihauer qui exploite la plus grande résistance des érythrocytes fœtaux aux acides pour les visualiser sur une lame de frottis (étalement de sang).
Ce test permet d’apprécier la quantité de globules rouges fœtaux présents dans le sang maternel.
Après dilution, le sang maternel est passé dans trois bains successifs. Le bain acide est à un pH (3,2) qui permet une destruction de l’hémoglobine maternelle, mais pas de l’hémoglobine fœtale. Les autres bains permettent une coloration des globules, en rouge si l’hémoglobine intacte est présente.
Au microscope, les globules maternels sont donc décolorés, au contraire des globules fœtaux ; il ne reste plus qu’à les compter.
Immunisation maternelle contre le Rhésus D ou allo-immunisation Rhésus D
En pratique, l’antigène qui pose le plus de problème est le Rhésus D (présent chez les individus Rh+). En effet, il s’agit d'un antigène très immunogène qui déclenche, à faible dose, des réactions immunitaires importantes responsables d’hémolyses potentiellement massives. La première grossesse d’un enfant Rh+ chez une femme Rh− ne pose qu’exceptionnellement un problème immunologique. Au terme d’une deuxième grossesse d’un enfant Rh+, environ 15 % des femmes Rh− sont porteuses d’une IgG anti-Rhésus D. Dès cette deuxième grossesse, la réponse immunitaire anti-D de la mère peut être réactivée. Les IgG anti-D passent alors le placenta et provoquent une destruction des globules rouges fœtaux d’intensité variable, minime à massive. Une hémolyse minime se manifeste essentiellement après l’accouchement par un ictère (jaunisse) anormalement sévère ou prolongé (tous les nouveau nés font un ictère physiologique bref et peu intense) : c’est la maladie hémolytique du nouveau né. Les hémolyses massives peuvent conduire à la mort du fœtus in utero.
Prévention des allo-immunisations fœto-maternelles
Il existe un certains nombre de traitements à mettre en œuvre pendant et après la grossesse pour prendre en charge les hémolyses in utero et néonatales et prévenir les complications potentiellement graves qu’elles occasionnent. Cependant, le meilleur traitement reste la prévention de l’allo-immunisation Rhésus maternelle (réaction maternelle contre le Rhésus D) qui repose sur l’administration intra-veineuse d’IgG anti-D, dans les situations à risque de passage de sang fœtal dans la circulation maternelle chez les femmes Rh− porteuses d’un enfant Rh+. Ces IgG se fixent sur les globules rouges fœtaux et préviennent la réaction immunitaire maternelle. Elles ne provoquent pas d’hémolyses significatives chez le fœtus. Cette mesure systématique a considérablement réduit le nombre d’accidents hémolytiques liés à l’antigène Rhésus D.
Par ailleurs, afin de prendre en charge au plus vite une hémolyse fœtale, on recherche systématiquement chez la femme Rh−, au cours d’une grossesse à risque (père Rh+), l’apparition d’une IgG anti-D. Des accidents pouvant survenir par allo-immunisation contre d’autre antigènes érythrocytaires, la recherche d’une IgG anti-antigène érythrocytaire est étendue à plusieurs autres systèmes antigéniques à risque ; comme le Kell, le Duffy et le Kidd. Cet examen de laboratoire est appelé une recherche d’agglutinines irrégulières ou RAI (notons qu’il serait plus correct de l’appeler recherche d’hémolysines irrégulières). Il est obligatoire lors de l’examen prénatal et deux fois au moins au cours de toute grossesse.
La figure ci-dessus présente, en animation, le principe du test utilisé pour détecter la présence ou non dans le sang d’un individu d’IgG dirigées contre divers antigènes érythrocytaires. Pour cela, on cherche à mettre en évidence la fixation de ces IgG sur des globules rouges dont les antigènes sont connus. On procède en parallèle sur de nombreux types de globules rouges, la comparaison des résultats permettant de déduire la ou les IgG présente(s).
À retenir
- La tolérance immunitaire du fœtus par la mère en particulier l’innocuité des IgM anti-A ou B.
- La possibilité de passage de globules rouges fœtaux dans la circulation maternelle avec développement d’une réponse immunitaire maternelle.
- Le risque d’apparition d’hémolysines anti-D chez les mères Rh−.
- Les conséquences potentiellement graves pour le fœtus de la présence d’une hémolysine anti-D chez la mère.
- La prévention de l’allo-immunisation Rhésus D par l’injection d’IgG anti-D dans les situations à risque.
- La recherche des anticorps irréguliers par la RAI.
Règles immunologiques de la transfusion sanguine : éviter le conflit antigène− anticorps
La transfusion sanguine aujourd’hui
Les situations médicales dans lesquelles on est amené à réaliser une transfusion sanguine à des malades sont fréquentes et variées, au premier rang desquelles les pertes de sang importantes par hémorragie grave. La transfusion dite « sanguine » consiste à administrer par voie intraveineuse des préparations de concentré de globules rouges (concentrés globulaires) obtenues à partir de sang de donneurs anonymes non rétribués. La gestion et la transformation des produits sanguins issus des dons sont assurées en France par l’Établissement français du sang.
Risque immunologique et notion de compatibilité
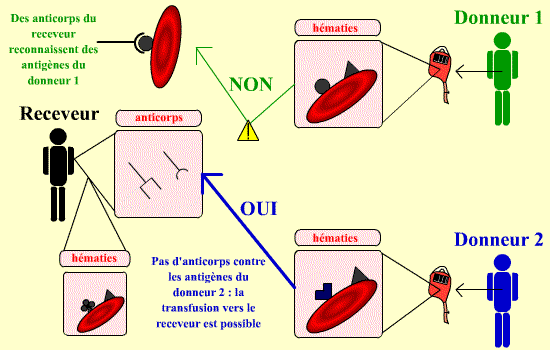
Le risque premier lors d’une transfusion sanguine est lié à la possibilité de réunir dans l’organisme du receveur (la personne transfusée) un anticorps et son antigène érythrocytaire. Les globules rouges du donneur sont dits compatibles avec le sang du receveur si le receveur ne présente pas d’anticorps circulants dirigés contre un antigène érythrocytaire du donneur.
Le sang d’un individu donneur est compatible avec celui d’un receveur si le sang de ce dernier ne possède pas d’anticorps dirigés contre les antigènes des hématies du donneur. Par exemple, ici, le receveur possède des anticorps reconnaissant certains antigènes du donneur 1 : ce donneur n’est donc pas compatible avec notre receveur. Par contre, le donneur 2 est, lui, compatible : le receveur ne possède pas d’anticorps dirigés contre ses antigènes.
On peut noter qu’il est tout à fait possible que le donneur possède des antigènes différents, au moins en partie, de ceux du receveur ; l’important est la présence ou l’absence d’anticorps. C’est pour cela que l’on effectue des recherches de la présence de tels anticorps, par RAI.
Compatibilité dans le système ABO : impératif transfusionnel
Les IgM anti-A ou anti-B étant des anticorps naturels et réguliers (elles sont naturellement présentes dans le sérum de tous les individus sauf les individus de groupe AB qui ne représentent que 5 % de la population européenne caucasienne), la précaution minimum et impérative est de transfuser du sang compatible dans le système ABO. Au mieux, le sang sera de même groupe ABO, on parle alors de transfusion isogroupe. Le non-respect de cette compatibilité ABO provoque toujours un accident transfusionnel grave par lyse massive des globules rouges transfusés. L’hémolyse est due à l’activation du complément par la fixation des IgM anti-A ou B sur les globules rouges incompatibles transfusés. Non seulement la transfusion est inefficace, mais les conséquences de l’hémolyse massive sont très graves pouvant conduire à l’arrêt circulatoire ou à des lésions viscérales notamment rénales très sévères (toxicité rénale de l’hémoglobine libre libérée en grande quantité).
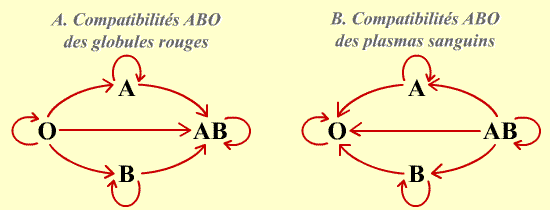
Un individu de groupe AB n’a pas d’IgM anti-A ou B circulantes, il peut donc recevoir du sang des trois autres groupes du système ABO : on parle de receveur universel dans le système ABO. À l’inverse, un individu de groupe O présente une IgM anti-A et une IgM anti-B dans son sérum mais ses globules rouges ne portent pas d’antigène du système ABO. Il ne peut donc recevoir du sang que du groupe O, mais son sang est compatible avec celui des trois autres groupes du système ABO : on parle de donneur universel dans le système ABO. Ces règles de compatibilité entre des groupes différents dans le système ABO sont utilisées quand on ne dispose pas d’assez de sang du groupe exact du malade à transfuser, le groupe O étant réservé aux situations d’urgence où l’on ne connaît pas le groupe sanguin du receveur.
A. Compatibilité ABO des globules rouges. Les flèches indiquent quelles sont les transfusions possibles (donneur vers receveur). Ces compatibilités supposent l’absence d’hémolysines chez les donneurs.
B. Compatibilité ABO des plasmas. Même signification des flèches qu’en A.
Risque lié aux hémolysines du sérum du donneur
Dans ces situations de transfusion non isogroupe, les IgM anti-A ou anti-B présentes dans les concentrés globulaires ne posent, le plus souvent, pas de problème, car elles ne sont pas en quantité suffisante pour provoquer une hémolyse au cours des transfusions standards. Il existe cependant une situation à risque d’accident hémolytique lorsque l’on transfuse du sang provenant d’un donneur présentant une IgG anti-A ou anti-B. Ce type d’hémolysine rare se retrouve surtout chez les donneurs de groupe O et apparaît par commutation à partir d’une IgM anti-A ou anti-B. Le potentiel hémolytique est beaucoup plus important que pour les IgM ce qui explique que des accidents se produisent pour des quantités très faibles d’hémolysines transfusées au cours de transfusions standards. C’est pourquoi on parle de donneur universel dangereux pour les individus de groupe O présentant une hémolysine du système ABO : leur sang est réservé à des transfusions isogroupes.
Risque lié aux hémolysines du sérum du receveur
Les anticorps dirigés contre les antigènes érythrocytaires non ABO sont immuns et irréguliers. Leur présence dans le sang d’un individu est le plus souvent due à une immunisation contre un ou plusieurs antigènes, lors d’une transfusion sanguine antérieure, ou chez la femme lors d’une grossesse. Le risque est plus important pour les antigènes les plus immunogènes comme le Rhésus D mais aussi les autres Rhésus (E>c>e>C), le K, le Duffy Fya, le Kidd Jka, etc.
En pratique, on ne peut tenir compte de tous ces antigènes pour réaliser une transfusion, faute de quoi on ne disposerait jamais du bon groupe sanguin au bon moment, d’autant moins que certaines associations antigéniques sont très rares (Rhésus DEC < 0,3 % population occidentale).
La transfusion standard ne tient compte que du groupe dans le système ABO, plus le Rhésus D (Rh+ ou Rh−).
Dans les situations à risque d’apparition d’une hémolysine ou celle où cette hémolysine serait particulièrement dangereuse, on tient compte d’un certain nombre d’autres systèmes dont au moins les Rhésus C et E et le Kell. Il s’agit des enfants, des femmes en âge de procréer, et des malades transfusés à plusieurs reprises. En cas de présence d’une ou plusieurs hémolysines, la compatibilité dans les systèmes concernés doit être respectée. On est parfois même amené à vérifier au cas par cas la compatibilité entre sérum du patient et globules rouges à transfuser.
De façon préventive, on vérifie donc avant chaque transfusion sanguine l’absence d’hémolysine dans le sang du malade par la pratique d’une recherche d’agglutinines irrégulières dans le sérum du receveur.
À retenir
- Le risque central de conflit antigène-anticorps lors d’une transfusion sanguine.
- La gestion du risque dû aux anticorps naturels réguliers anti-A ou B par les règles de compatibilité ABO.
- Le risque lié aux hémolysines anti A-ou B des donneurs O dangereux.
- Le risque lié à la présence d’anticorps immuns irréguliers chez le receveur, la détection par la RAI.
- Le nombre variable de systèmes antigéniques concernés par la compatibilité selon les situations pathologiques : du minimum ABO RhD à des phénotypages étendus ou des vérifications in vitro de la compatibilité entre sérum du receveur et globules du donneur.
Conclusion générale
Le statut immunologique particulier des globules rouges et l’importance de la réaction humorale que certains antigènes érythrocytaires peuvent induire sont à l’origine de diverses situations pathologiques plus ou moins graves. La connaissance de la physiologie de cette réponse anti-érythrocytaire permet aujourd’hui de prendre en charge au mieux ces situations, en particulier par la prévention du risque d’allo-immunisation Rhésus chez les mères Rh− et du risque immunologique transfusionnel.
Malgré des précautions draconiennes, l’accident transfusionnel le plus fréquent reste l’accident immunologique dû à un conflit antigène érythrocytaire-anticorps, loin devant le risque de transmission de micro-organismes pathogènes comme le VIH ou les virus des hépatites B et C. Néanmoins, ces accidents sont rares et la médecine transfusionnelle permet chaque année de sauver de très nombreuses vies.
On rappellera donc l’importance du don de sang anonyme et gratuit, spontané ou dans le cadre de campagne de collecte à grande échelle, ouvert à toute personne dès la majorité. La solidarité de chacun est d’autant plus importante que le déficit en sang est chronique et que certaines situations exigent une compatibilité très poussée (nombreux systèmes pris en compte) entre le sang à transfuser et le receveur, à tel point que, parfois, le sang le plus approprié n’est malheureusement pas disponible.
Site du DON du sang de l'Etablissement français du sang